早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;②部
题目详情
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).
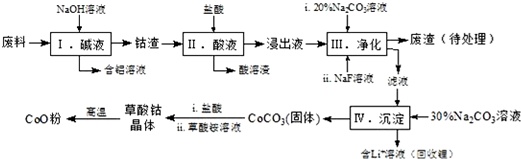
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:___.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___;废渣中的主要成分除了LiF外,还有___.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是___.温度高于890℃时,固体产物发生分解反应,固体产物为___.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:___.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___;废渣中的主要成分除了LiF外,还有___.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
▼优质解答
答案和解析
(1)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
故答案为:Co2O3+6H++2Cl-=2 Co2++Cl2↑+3H2O;
(2)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:7.15;Fe(OH)3;
(3)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(4)计算晶体物质的量n=
=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g=4.41g=1.08g,说明210°C失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,210~290℃过程中产生的气体只有CO2,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加费用的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
=0.02mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2
Co3O4+6CO2,温度高于890℃时,固体产物发生分解反应,得到固体的质量为2.25g,根据前面的计算可知,固体中只含有钴元素和氧元素,其中含有钴元素的质量为0.03×59g=1.77g,所以固体中含有氧元素的质量为0.48g,其物质的是来0.03mol,所以固体中钴原子与氧原子的物质的量之比为0.03:0.03=1:1,所以固体的化学式为CoO,
故答案为:3CoC2O4+2O2
Co3O4+6CO2;CoO.
故答案为:Co2O3+6H++2Cl-=2 Co2++Cl2↑+3H2O;
(2)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:7.15;Fe(OH)3;
(3)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(4)计算晶体物质的量n=
| 5.49g |
| 183g/mol |
| 0.64g |
| 32g/mol |
| ||
故答案为:3CoC2O4+2O2
| ||
看了钴(Co)及其化合物在工业上有...的网友还看了以下:
设双曲线C的中心在原点,以抛物线的顶点为双曲线的右焦点,抛物线的准线为双曲线的右准线.(1)试求双 2020-04-08 …
求直线l:y=2x+3关于直线l:y=x+1对称的直线l2的方程一个过程不懂有一种解法是:由联立y 2020-06-02 …
直线AB与直线OA交于点A(3,3),点B的坐标为(9,0)设点P(x,0)在线段OB上运动(不与 2020-06-14 …
关于极坐标中直线参数方程的参数几何意义,不难极坐标中,过曲线ρ(cosθ)^2+cosθ-ρ=0外 2020-06-14 …
如图,在棱长为a的正方体ABCD-A1B1C1D1中,M、N分别是AA1、D1C1的中点,过D、M 2020-07-09 …
如图,△ABC中,AB=AC,∠BAC=90°,直线l经过点A,BD⊥l于D,CE⊥了于D,CE⊥ 2020-07-22 …
几何证明难题,求证,已知如图,梯形ABCD中,AD‖BC,以两腰AB,CD为一边分别向两边作正方形 2020-07-25 …
两圆相离的圆系问题已知圆f(x,y)与直线L,求圆f(x,y)关于直线L的对称圆g(x,y),其中 2020-07-26 …
求与圆C:x^2+y^2-x+2y=0关于直线l:x-y+1=0对称的圆的方程2011-02-求与圆 2020-12-26 …
点和直线的问题已知直线L过点P(2,3),且和两平行直线L1:3X+4Y-7=0L2:3X+4Y+8 2021-01-10 …