在一定条件下,容积分别为1L和2L的甲、乙两密闭容器中同时充入2molA和2molB的混合气体,发生如下反应:2A(g)+B(g)xC(g)ΔH=QkJ·mol-1,保持甲、乙两容
在一定条件下,容积分别为 1 L 和 2 L 的甲、乙两密闭容器中同时充入 2 mol A 和 2 mol B 的混合气体,发生如下反应: 2A (g) + B(g) x C(g) Δ H = Q kJ·mol - 1 ,保持甲、乙两容器温度不变且相同,两容器中有关 A 的量随时间的变化如图:
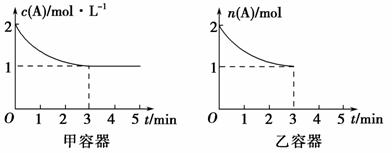
(1) 根据上述图像判断, x ________3( 填 “>”“ = ” 或 “<”) 。写出该反应的平衡常数表达式: K = ________ ,已知温度升高时, K 值减小,则 Q ________0( 填 “>”“ = ” 或 “<”) 。
(2) 用 B 物质表示从 0 ~ 3 min 内乙容器中反应的平均速率 v (B) = ________ 。 ( 结果保留三位小数 )
(3) 能说明甲容器中反应达到平衡状态的是 ________( 填编号 ) 。
a . 2 n (A) = n (B) = x · n (C)
b . c (A) 、 c (B) 、 c (C) 保持一个定值
c . x · v 逆 (B) = v 正 (C)
d .甲容器中气体的密度保持不变
(4) 甲、乙两容器中反应达到平衡时所耗时间相同,原因可能是 __________________________ 。
解析 (1) 投料量相同,体积不同,甲中压强大,平衡时甲中 A 为 1 mol ,乙中 A 也为 1 mol ,即两体系中各物质的物质的量相同,相当于改变压强平衡没移动,所以 x = 3 ;升高温度 K 值变小,即平衡向逆反应方向移动,所以正反应是放热反应,所以 Q <0 。 (2) 先求出 A 的速率: v (A) = ![]() =
= 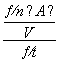 =
= ![]() =
= ![]() mol·L - 1 ·min - 1 , B 的速率是 A 的一半,即 v (B) =
mol·L - 1 ·min - 1 , B 的速率是 A 的一半,即 v (B) = ![]() v (A) =
v (A) = ![]() ×
× ![]() mol·L - 1 ·min - 1 ≈0.083 mol·L - 1 ·min - 1 ,要注意容器的体积。
mol·L - 1 ·min - 1 ≈0.083 mol·L - 1 ·min - 1 ,要注意容器的体积。
(3)a 项,具体反应过程中各物质的量的多少不能作为平衡判断的依据; b 项,各物质的浓度不变,则说明反应已达到平衡; c 项,即正逆反应速率相等,是平衡标志; d 项,固定体积的容器,反应体系中各物质都是气态的反应,反应过程中密度一直不变,所以密度不变不能作为该反应的平衡标志。
(4) 乙中反应物浓度小于甲,而反应速率与甲相同,故乙中可能使用了催化剂。
答案 (1) = ![]() < (2)0.083 mol·L - 1 ·min - 1 (3)bc (4) 乙容器中有催化剂
< (2)0.083 mol·L - 1 ·min - 1 (3)bc (4) 乙容器中有催化剂
将重力均为G的两磁环A,B套在光滑的塑料家上磁环A悬浮在空中设A,B两环所受的支持力分别有F,F2选 2020-03-31 …
已知指数函数y=g(x)满足:g(2)=4,定义域为R,函数f(x)=−g(x)+n2g(x)+m 2020-05-02 …
已知指数函数g(x)=ax满足:g(−3)=18,定义域为R的函数f(x)=g(x)−1g(x)+ 2020-05-02 …
快来拿分设f(x)=ax^2+bx+c(a>b>c,a不为0),且f(1)=0,g(x)=ax+b 2020-06-05 …
已知二次函数y=f(x)的定义域为R,f(1)=2,且在x=m时取得最值,若y=g(x)为一次函数 2020-06-06 …
g到底代表什么?我们都知道,G=mg这个公式是说重力等于质量与重力与质量的比值的积,所以得到g等于 2020-07-29 …
若对于正整数k、g(k)表示k的最大奇数因数,例如g(3)=3,g(20)=5,并且g(2m)=g 2020-07-31 …
两根相同的轻弹簧S1、S2,劲度系数皆为k=400N/m.悬挂的重物的质量分别为m1=2kg和m2= 2020-11-01 …
物理力学公式里字母的意思是什么?V=S/t2、重力:G=mg3、密度:ρ=m/V4、压强:p=F/S 2020-11-04 …
设函数f(x)=x-1ex的定义域为(-∞,0)∪(0,+∞)(I)当f(x)时,求函数[m,m+1 2021-01-31 …