早教吧作业答案频道 -->化学-->
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.(1)试
题目详情
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.
(1)试推测能组成这种溶液的可能的溶质组合有___种(填数字).
(2)有关这种溶液,下列说法不正确的是___
A.若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3•H2O
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
C.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
D.若溶液中c(NH3•H2O)>c(Cl-),则溶液一定显碱性
(3)若溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl___c(NH3•H2O)(填“>”、“<”或“=”),简述理由___.
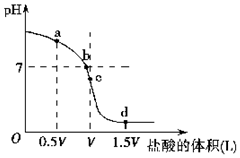
(4)水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的HCl滴定V L同浓度NH3•H2O时得到的滴定曲线.试分析如图所示滴定过程中的a、b、c、d各点,水的电离程度最大的是___理由为___.
(5)写出a点、c点所对应溶液中各离子浓度由大到小的比较顺序
a点:___.
c点:___.

(1)试推测能组成这种溶液的可能的溶质组合有___种(填数字).
(2)有关这种溶液,下列说法不正确的是___
A.若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3•H2O
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
C.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
D.若溶液中c(NH3•H2O)>c(Cl-),则溶液一定显碱性
(3)若溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl___c(NH3•H2O)(填“>”、“<”或“=”),简述理由___.
(4)水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的HCl滴定V L同浓度NH3•H2O时得到的滴定曲线.试分析如图所示滴定过程中的a、b、c、d各点,水的电离程度最大的是___理由为___.
(5)写出a点、c点所对应溶液中各离子浓度由大到小的比较顺序
a点:___.
c点:___.
▼优质解答
答案和解析
(1)某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知该溶液中含有一种或两种溶质,查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,依据溶液中存在的阴阳离子结合电荷守恒分析判断可能的溶质微粒为,NH4Cl、NH3•H2O和NH4Cl、NH4Cl和HCl,组成这种溶液的可能的溶质组合有3种,
故答案为:3;
(2)A.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3•H2O,故A正确;
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质可以是NH4Cl或NH4Cl和HCl混合溶液,故B错误;
C.若溶液中c(NH4+)=c(Cl-),溶液中电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(OH-)=c(H+),则该溶液一定显中性,故C正确;
D.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中c(NH3•H2O)>c(Cl-),则溶液中溶质为NH3•H2O和NH4Cl,一定显碱性,故D正确;
故答案为:B.
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则c(H+)=c(OH-),溶液中的溶质是氯化铵和氨水;要使混合溶液呈中性,则氨水的物质的量大于HCl,混合前c(HCl)3•H2O),pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)3•H2O),
故答案为:<;pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)3•H2O)
(4)NH3•H2O对水的电离起抵制作用,而NH4Cl对水的电离起促进作用,所以两者恰好完全反应生成氯化铵,对水电离促进程度最大,即为c,
故答案为:c;分析题图可知,c点时盐酸和氨水正好完全反应,生成氯化铵溶液,这时水的电离程度最大;
(5)a点是等浓度的氨水和氯化铵的混合物,一水合氨电离大于铵根离子电离溶液显碱性,溶液中离子浓度:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c点是恰好完全反应生成的氯化铵溶液,铵根离子水解溶液显酸性,离子浓度为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:3;
(2)A.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3•H2O,故A正确;
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质可以是NH4Cl或NH4Cl和HCl混合溶液,故B错误;
C.若溶液中c(NH4+)=c(Cl-),溶液中电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(OH-)=c(H+),则该溶液一定显中性,故C正确;
D.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中c(NH3•H2O)>c(Cl-),则溶液中溶质为NH3•H2O和NH4Cl,一定显碱性,故D正确;
故答案为:B.
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则c(H+)=c(OH-),溶液中的溶质是氯化铵和氨水;要使混合溶液呈中性,则氨水的物质的量大于HCl,混合前c(HCl)
故答案为:<;pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)
(4)NH3•H2O对水的电离起抵制作用,而NH4Cl对水的电离起促进作用,所以两者恰好完全反应生成氯化铵,对水电离促进程度最大,即为c,
故答案为:c;分析题图可知,c点时盐酸和氨水正好完全反应,生成氯化铵溶液,这时水的电离程度最大;
(5)a点是等浓度的氨水和氯化铵的混合物,一水合氨电离大于铵根离子电离溶液显碱性,溶液中离子浓度:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c点是恰好完全反应生成的氯化铵溶液,铵根离子水解溶液显酸性,离子浓度为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c(Cl-)>c(NH4+)>c(H+)>c(OH-);
看了经测定某溶液中只含NH4+、C...的网友还看了以下:
①由an=3a(n-1)-2n+3(n=2,3……)构造等比数列②已知an为等比数列①一种方法可以 2020-04-27 …
已知-1小于等于x小于等于1,n大于等于2,且n属于N正,求证:(1-x)的n次方+(1+x)的n 2020-05-13 …
初三数学二次根式(1)若m,n为一等腰△的两边之长,且满足等式2根号(3m-6)+3根号(2-m) 2020-06-06 …
为什么已知一个Sn的公式,要求an需要分n等于1及n大于等于2这两种情况?为什么另Sn减去Sn-1 2020-06-17 …
有N个球,其中有n种颜色且每种颜色球的数量都是相等的,抽X个球不放回抽样,求抽到全部颜色球的概率? 2020-06-22 …
用四个全等的正八边行进行拼接,使相等的两个正八边形有一条公共边,围成一圈后中间形成一个正方形,用n 2020-07-31 …
设A为n阶矩阵,且其行列式为a不等于0证明它可以通过第三种初等变换化为对角矩阵diag(1,1,设 2020-08-02 …
正数的n次方和n次方根有无区别?最近看书有两种说法:(1)正数的n次方等于正数(指数函数y=a^x, 2020-11-06 …
如何推算出以下数学公式:N乘N加D的和分之D等于N分之一减去N加D的和分之一N乘N加D的和分之一等于 2020-12-17 …
宝石排列问题N等于4时,输出的测试结果是多少?现有n种不同形状的宝石,每种n颗,共n*n颗。同一种形 2020-12-24 …