碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )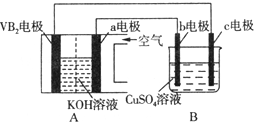
A. VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05mol/L
B、外电路中电子由VB2电极流向阴极c电极,故B错误;
C、电解过程中,与氧气相连的b为阳极,氢氧根失电子生成氧气,故C错误;
D、当外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即
| 0.448L |
| 22.4L/mol |
| 0.04-0.01×2 |
| 2 |
| 0.01 |
| 0.2 |
故选D.
数学如图所示,已知抛物线的对称轴是直线x=5/2,抛物线与x轴相交于A、B(4,0)两点,如图所示, 2020-03-30 …
几道轨迹方程的数学题1.三角形ABC的顶点B,C坐标分别是(0,0)(4,0)AB边上的中线长为3 2020-04-27 …
已知二次函数y=ax²+bx+c的图像如图所示 (1)求a、b、c的值 (2)求顶点M的坐标 (3 2020-05-13 …
抛物线y=x²+4与y轴的交点坐标是A(4,0)B(-4,0)C(0,-4)D(0,4) 2020-06-14 …
已知直线y=-2x+4与x轴,y轴分别相交与A(-2,0)、C(0,4).抛物线y=-1/2X的平 2020-06-14 …
在△ABC中,B(4,0),C(-4,0),动点A满足sinB-sinC=1/2sin在△ABC中 2020-07-19 …
抛物线y=-x平方+3x+4与x轴交于点A(-1,0),点B(4,0),与y轴交于点C(0,4)( 2020-07-30 …
不等式(x+3)(x-5)<0用集合描述法表示-4.0,0可表示为. 2020-08-01 …
已知点A(-1,0),B(4,0),点C在y轴的正半轴上看问题补充最后一条!有第三题解即可(2012 2020-11-12 …
可不可以把已知A(0,2),B(4,0),点C在坐标轴上,且三角形ABC是以AB为底的等腰三角形,求 2020-12-25 …