早教吧作业答案频道 -->化学-->
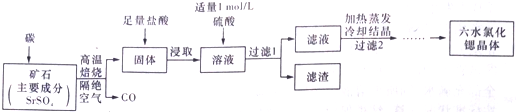
一种工业制备SrCl•6H2O的生产流程如下:已知:①M(SrCl2•6H2O)=267g/mol;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质
题目详情
一种工业制备SrCl•6H2O的生产 流程如下:
已知:①M(SrCl2•6H2O)=267g/mol;
②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质.
(1)隔绝空气高温焙烧,若2mol SrSO4中只有S被还原,转移了16mol电子.写出该反应的化学方程式:___.
(2)过滤2后还需进行的两步操作是___、___.
(3)加入硫酸的目的是___;为了提高原料的利用率,滤液中Sr2+的浓度应不高于___ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L).
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO31.100×10-2 mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出.
①滴定反应达到终点的现象是___.
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为___(保留4位有效数字).

已知:①M(SrCl2•6H2O)=267g/mol;
②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质.
(1)隔绝空气高温焙烧,若2mol SrSO4中只有S被还原,转移了16mol电子.写出该反应的化学方程式:___.
(2)过滤2后还需进行的两步操作是___、___.
(3)加入硫酸的目的是___;为了提高原料的利用率,滤液中Sr2+的浓度应不高于___ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L).
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO31.100×10-2 mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出.
①滴定反应达到终点的现象是___.
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为___(保留4位有效数字).
▼优质解答
答案和解析
SrSO4和碳隔绝空气高温焙烧生成CO、固体,固体加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,过滤除去,滤液中含SrCl2等,最后蒸发浓缩、冷却结晶、洗涤、干燥得到SrCl2•6H2O.
(1)SrSO4和碳隔绝空气高温焙烧,C发生氧化反应生成CO,设S元素在还原产物中化合价为x,根据电子转移守恒,则6mol×(6-x)=16mol,解得x=-2,故还原产物为CrS,反应方程式为:SrSO4+4C
SrS+4CO↑,
故答案为:SrSO4+4C
SrS+4CO↑;
(2)将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,
故答案为:洗涤、干燥;
(3)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,
由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=
mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=
mol/L=0.03mol/L,
故答案为:除去溶液中Ba2+杂质;0.03;
(4)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,
故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,
1.000g产品中SrCl2•6H2O的物质的量为:n(SrCl2•6H2O)=
×n(Ag+)=3.5×10-3mol,
1.000g产品中SrCl2•6H2O的质量为:m(SrCl2•6H2O)=3.5×10-3mol×267 g/mol=0.9345g,
所以产品纯度为:
×100%=93.45%,
故答案为:93.45%.
(1)SrSO4和碳隔绝空气高温焙烧,C发生氧化反应生成CO,设S元素在还原产物中化合价为x,根据电子转移守恒,则6mol×(6-x)=16mol,解得x=-2,故还原产物为CrS,反应方程式为:SrSO4+4C
| ||
故答案为:SrSO4+4C
| ||
(2)将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,
故答案为:洗涤、干燥;
(3)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,
由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=
| 1.1×10-10 |
| 1×10-5 |
| 3.3×10-7 |
| 1.1×10-5 |
故答案为:除去溶液中Ba2+杂质;0.03;
(4)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,
故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,
1.000g产品中SrCl2•6H2O的物质的量为:n(SrCl2•6H2O)=
| 1 |
| 2 |
1.000g产品中SrCl2•6H2O的质量为:m(SrCl2•6H2O)=3.5×10-3mol×267 g/mol=0.9345g,
所以产品纯度为:
| 0.9435g |
| 1g |
故答案为:93.45%.
看了 一种工业制备SrCl•6H2...的网友还看了以下:
设f(x,y)在(0,0)处连续,limx,y→0f(x,y)-1ex2+y2-1=4,则()A. 2020-05-14 …
在一定温度下,A、B能在溶液中发生反应生成C和D:A+B=C+Da、将0.2mol/LA溶液和0. 2020-05-14 …
已知抛物线y=ax2+bx+c经过A(1,0),B(3,0)C(0,3)三点.27.已知抛物线y= 2020-05-19 …
如果圆x2+y2+ax+by+c=0(abc不全为零)与y轴相切于原点,那么()A.a=0,b≠0 2020-07-20 …
若圆x^2+y^2+ax+by-c=0,(a,b,c不全为0)与x轴相切于原点则Aa=0,b≠0, 2020-07-20 …
怎么随机产生0,1,并且0的概率比1概率大很多.求帮助,谢谢.最好用rand(),例如:1概率0. 2020-07-30 …
大一新生,数列发散问题:下列数列发散的是()(A)1,0,1,0,……(B)1/2,0,1/4,大 2020-07-31 …
f(x)在[0,1]上二阶可微且f'(0)=f'(1)=0,则存在c,使得f''(c)≥4|f(1) 2020-11-03 …
△=0,△<0时一元二次方程ax2+bx+c=0(a>0)的根根需要用字母代表出来△>0,△=0,△ 2020-12-27 …
求文档:f(x)=a*x^2+b*x+c,a>b>c,a+b+c=0,若存在实数x,使得a*x^2+ 2021-01-01 …