早教吧作业答案频道 -->化学-->
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.步骤现象Ⅰ.取5mL0.1mol/LAgNO3与一定体积0.1mol/LNaCl溶液,混合,振荡.立即产生白色沉淀Ⅱ.向所
题目详情
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
(1)为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为___.
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=___.
(3)步骤V中产生的白色沉淀的化学式为___,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有___.
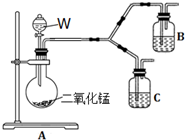
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和___,试剂W为___.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为___.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□___+□___⇌□AgCl+□S+□___
C中NaCl的作用是:___.
| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=___.
(3)步骤V中产生的白色沉淀的化学式为___,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有___.
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和___,试剂W为___.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为___.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□___+□___⇌□AgCl+□S+□___
C中NaCl的作用是:___.

▼优质解答
答案和解析
(1)要证明沉淀变黑是AgCl转化为Ag2S的缘故,则步骤Ⅰ中必须使硝酸银电离出的银离子完全转化成AgCl沉淀,所以加入的NaCl溶液的体积必须≥5mL,
故答案为:≥5mL;
(2)氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq),该反应的平衡常数为:K=
═
=
=
=5.4×109,
故答案为:5.4×109;
(3)步骤Ⅲ中较长时间后,沉淀变为乳白色,则黑色的硫化银沉淀转化成氯化银沉淀;
再根据滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液,产生红棕色气体,沉淀部分溶解,则被氧化的只能为S元素,故乳白色沉淀为AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根离子,则在步骤Ⅴ中向X中滴加Ba(NO3)2溶液会生成BaSO4沉淀,
故答案为:BaSO4;S;
(4)①根据图示可知,装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗;乳白色沉淀为氯化银和S的混合物,装置A的作用是提供氧气,根据圆底烧瓶中为二氧化锰可知W为过氧化氢溶液,
故答案为:分液漏斗;过氧化氢溶液;
②进一步确认步骤Ⅲ中乳白色沉淀产生的原因,装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,则装置B中应该不含氯化钠溶液,即为Ag2S悬浊液,通过对比反应现象判断生成乳白色沉淀产生的原因,
故答案为:Ag2S悬浊液;
③装置C中生成的白色沉淀为氯化银和S单质,反应物应该还有氧气,产物中钠离子只能以强氧化钠形式存在,则未知的反应物为强氧化钠,再根据H元素守恒可知另一种未知反应物为水,然后根据化合价升降相等配平可得反应方程式:2Ag2S+4NaCl+O2+2H2O⇌4AgCl+2S+4NaOH;
装置C中氯化钠的作用为:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与溶液中银离子结合生成AgCl沉淀,使溶液中c(Ag+)减小,从而有利于氧化还原反应2Ag2S+4NaCl+O2+2H2O⇌4AgCl+2S+4NaOH向右移动,
故答案为:2Ag2S+4NaCl+O2+2H2O⇌4AgCl+2S+4NaOH;氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
故答案为:≥5mL;
(2)氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq),该反应的平衡常数为:K=
| c2(Cl-) |
| c(S2-) |
| c2(Ag+)•c2(Cl-) |
| c2(Ag+)•c(S2-) |
| K2sp(AgCl) |
| Ksp(Ag2S) |
| (1.8×10-10)2 |
| 6×10-30 |
故答案为:5.4×109;
(3)步骤Ⅲ中较长时间后,沉淀变为乳白色,则黑色的硫化银沉淀转化成氯化银沉淀;
再根据滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液,产生红棕色气体,沉淀部分溶解,则被氧化的只能为S元素,故乳白色沉淀为AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根离子,则在步骤Ⅴ中向X中滴加Ba(NO3)2溶液会生成BaSO4沉淀,
故答案为:BaSO4;S;
(4)①根据图示可知,装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗;乳白色沉淀为氯化银和S的混合物,装置A的作用是提供氧气,根据圆底烧瓶中为二氧化锰可知W为过氧化氢溶液,
故答案为:分液漏斗;过氧化氢溶液;
②进一步确认步骤Ⅲ中乳白色沉淀产生的原因,装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,则装置B中应该不含氯化钠溶液,即为Ag2S悬浊液,通过对比反应现象判断生成乳白色沉淀产生的原因,
故答案为:Ag2S悬浊液;
③装置C中生成的白色沉淀为氯化银和S单质,反应物应该还有氧气,产物中钠离子只能以强氧化钠形式存在,则未知的反应物为强氧化钠,再根据H元素守恒可知另一种未知反应物为水,然后根据化合价升降相等配平可得反应方程式:2Ag2S+4NaCl+O2+2H2O⇌4AgCl+2S+4NaOH;
装置C中氯化钠的作用为:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与溶液中银离子结合生成AgCl沉淀,使溶液中c(Ag+)减小,从而有利于氧化还原反应2Ag2S+4NaCl+O2+2H2O⇌4AgCl+2S+4NaOH向右移动,
故答案为:2Ag2S+4NaCl+O2+2H2O⇌4AgCl+2S+4NaOH;氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
看了 下表是某学生为探究AgCl沉...的网友还看了以下:
已知圆o:x^2y^2=4和点M(1,a).若a=3,求过点M作圆O的切线的切线长已知圆o:x^2 2020-04-27 …
在正方体ABCD-A1B1C1D1中,O是BD1中点,A1C交平面AB1D1于M.则以下说法中:( 2020-05-17 …
已知圆M的方程为:x²+y²-2x-2y-6=0,以坐标原点为圆心的圆O与圆M相切已知圆M的方程为 2020-06-27 …
已知在正方体ABCD-A1B1C1D1中,O是DB的中点,直线A1C交平面C1BD于点M,判断下列 2020-07-09 …
1.若集合A={x|(a-1)x^2+2x+1=o}中只含有一个元素,求实数a2.已知集合A={1, 2020-12-07 …
关于圆的方程,直线l1:m*x-y=0,l2:x+m*y-m-2=o已知直线l1:m*x-y=0,l 2020-12-10 …
为了使得行车视野开阔,拟定在某直角型街角O的两边各取一点A,B,修建隔离墙AB和种植草坪△OAB.为 2020-12-15 …
如图,O为△ABC内一点,∠A=80°,∠CBO=1/m∠CBA,∠BCO=1/m∠BCA(1)若m 2020-12-25 …
O为三角形ABC内一点,∠A=80°,∠BCO=1/m∠BCA∠CBO=1/m∠CBA1.若m=2, 2020-12-25 …
如图,O为△ABC内一点,∠A=80°,∠CBO=1/m∠CBA,∠BCO=1/m;;∠BCA①若m 2020-12-25 …