早教吧作业答案频道 -->化学-->
已知:反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3反应I和Ⅱ反应在不
题目详情
已知:反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
(1)①推测反应I是反应___(填“吸热”或“放热”),②150oC时,反应Ⅲ的平衡常数表达式K=___,温度升高,K值___(填“增大”或“减小”).
(2)相同条件下,反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=___,
②下列说法不正确的是___.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率
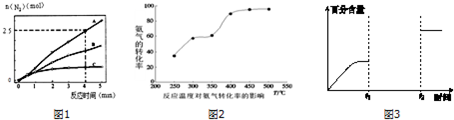
你认为反应控制的最佳温度应为___,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=___,
②下列说法不正确的是___.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率

你认为反应控制的最佳温度应为___,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
▼优质解答
答案和解析
(1)①反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1,平衡常数K1>K1′,升温平衡常数减小,说明平衡逆向进行,正反应为放热反应;
故答案为:放热;
②已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I-反应II×3得到反应III,则△H3=△H1-3△H2,已知|△H1|=2|△H2|,所以△H3=△H1-3△H2=|△H2|>0,即反应III为吸热反应,150oC时,反应Ⅲ4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l),的平衡常数表达式K3=
;温度升高平衡正向进行,平衡常数增大,
故答案为:
;增大;
(2)①4min时氮气为2.5mol,则消耗的NO为2.5mol×
=3mol,所以v(NO)=
=0.375mol•L-1•min-1,
故答案为:0.375mol•L-1•min-1;
②A.可逆反应到达平衡时12个O-H断裂,同时生成12个O-H键,而生成12个O-H键需要12个N-H断裂,单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡,故A正确;
B.恒容绝热的密闭容器中,反应中温度会变化,则K会变化,当K值不变时,说明温度不变,反应已经达到平衡,故B正确;
C.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,故活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故C错误;
D.反应达到平衡后,升高温度,速率增大,平衡向逆反应方向进行,逆反应速率从大到小,逆反应速率先增大后减小,故D正确;
E.由如图1可知,催化剂A改变反应速率,不改变化学平衡,不能使反应进行的程度更大,故E正确,
故答案为:CE;
(3)由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故选C,
故答案为:C;
(4)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为: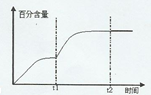 ,
,
答:N2的百分含量随时间变化图象 .
.
故答案为:放热;
②已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I-反应II×3得到反应III,则△H3=△H1-3△H2,已知|△H1|=2|△H2|,所以△H3=△H1-3△H2=|△H2|>0,即反应III为吸热反应,150oC时,反应Ⅲ4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l),的平衡常数表达式K3=
| c3(O2)c5(N2) |
| c4(NH3)c6(NO2) |
故答案为:
| c3(O2)c5(N2) |
| c4(NH3)c6(NO2) |
(2)①4min时氮气为2.5mol,则消耗的NO为2.5mol×
| 6 |
| 5 |
| ||
| 4min |
故答案为:0.375mol•L-1•min-1;
②A.可逆反应到达平衡时12个O-H断裂,同时生成12个O-H键,而生成12个O-H键需要12个N-H断裂,单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡,故A正确;
B.恒容绝热的密闭容器中,反应中温度会变化,则K会变化,当K值不变时,说明温度不变,反应已经达到平衡,故B正确;
C.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,故活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故C错误;
D.反应达到平衡后,升高温度,速率增大,平衡向逆反应方向进行,逆反应速率从大到小,逆反应速率先增大后减小,故D正确;
E.由如图1可知,催化剂A改变反应速率,不改变化学平衡,不能使反应进行的程度更大,故E正确,
故答案为:CE;
(3)由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故选C,
故答案为:C;
(4)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为:
 ,
,答:N2的百分含量随时间变化图象
 .
.
看了已知:反应I:4NH3(g)+...的网友还看了以下:
已知二次函数y=a(x-h)²已知二次函数y=a(x-h)*2,当x=2时有最大值,且此函数的图像 2020-05-13 …
在两个相离的任意半径的圆内各取一个点,两点间的距离满足特定的概率分布么?假设两个圆半径大小已知,分 2020-07-26 …
设多项式h(x)被x的平方-1除后的余式为3x+4,并且已知h(x)有因式x.若h(x)被x(x的 2020-07-30 …
在三角形ABC中,已知B(-3,0)C(3,0),D为直线BC上一点,向量AD·向量BC=0,三角 2020-07-30 …
一元整式方程在梯形面积公式S=1/2(a+b)h中,已知S,b,h,且h≠0,则a=有过程 2020-08-02 …
已知线段ab=6,直线l平行于AB,点C在l上,CH垂直于AB垂足是H,且点H在线段AB上,CH= 2020-08-02 …
如图所示.极限滑雪运动员自高为H的雪山顶端由静止下滑,经圆弧状底端O后,恰能滑至右侧高为h的平台上, 2020-10-30 …
已知A,B两地相距100km.按交通法规规定:A,B两地之间的公路上车速要求不低于60km/h且不高 2020-11-07 …
甲乙两地相距skm,汽车从甲地匀速行驶到乙地,速度不得超过ckm/h,已知汽车每小时的运输成本(以元 2020-11-29 …
已知菱形ABCD的边长为2,∠DAB=60°,HF⊥DA于H,HF⊥CB的延长线于H,且HF与AB相 2020-12-05 …