早教吧作业答案频道 -->化学-->
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g).今在一容积可变的密闭容器中,充有10molCO和20molH2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关
题目详情
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
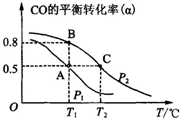
(1)写出该反应的平衡常数表达式为___.
(2)上述合成甲醇的反应为___反应(填“放热”或“吸热”).
A、B、C三点的平衡常数KA、KB、KC的大小关系为___.A、B两点对应的压强大小关系是PA___PB(填“大于”、“小于”或“等于”).
(3)若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为H2SO4溶液,则该电池工作时负极的电极反应式为___,理论上通过外电路的电子最多为___mol.

(1)写出该反应的平衡常数表达式为___.
(2)上述合成甲醇的反应为___反应(填“放热”或“吸热”).
A、B、C三点的平衡常数KA、KB、KC的大小关系为___.A、B两点对应的压强大小关系是PA___PB(填“大于”、“小于”或“等于”).
(3)若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为H2SO4溶液,则该电池工作时负极的电极反应式为___,理论上通过外电路的电子最多为___mol.
▼优质解答
答案和解析
(1)反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g),平衡常数K=
,故答案为:
;
(2)从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.相同温度下,增大压强平衡右移,CO的转化率增大,即CO转化率越大压强越大,
故答案为:放热; KA=KB>KC;小于;
(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH(g)+H2O-6e-=CO2+6H+.由图示可知,在平衡状态A时,CO转化率为0.5,可知生成甲醇的物质的量为5mol,根据电极反应式可知失去电子数为:5mol×6=30mol,
故答案为:CH3OH(g)+H2O-6e-=CO2+6H+;30.
| c(CH3OH) |
| c(CO)c(H2)2 |
| c(CH3OH) |
| c(CO)c(H2)2 |
(2)从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.相同温度下,增大压强平衡右移,CO的转化率增大,即CO转化率越大压强越大,
故答案为:放热; KA=KB>KC;小于;
(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH(g)+H2O-6e-=CO2+6H+.由图示可知,在平衡状态A时,CO转化率为0.5,可知生成甲醇的物质的量为5mol,根据电极反应式可知失去电子数为:5mol×6=30mol,
故答案为:CH3OH(g)+H2O-6e-=CO2+6H+;30.
看了利用CO和H2合成甲醇,其反应...的网友还看了以下:
1.PT切圆O于T,CT为直径,D为OC上的一点,支线PD交圆O于B和A,B在线段PD上,若CD= 2020-04-12 …
圆O与圆O'相较于点ABAC是圆O的直径CA的延长线交圆O'于DCB的延长线交圆O'于ECE=10 2020-04-27 …
如图,AB是圆O的直径,CD切圆O于点C,AD交于圆O点E,当AC满足什么条件时,AD垂直于CD, 2020-05-15 …
我无意用尺规画出了一个正四十九边形,(证明成立或不成立)画圆O在圆O上任取一点P40以P40为圆心 2020-05-16 …
AB是圆O的直径,BM垂直于AB于B点,点C是射线BM上异于端点的一动点,AC交圆O于D点,过D点 2020-05-16 …
如图,PB切⊙O于B点,直线PO交⊙O于点E,F,过点B作PO的垂线BA,垂足为点D,交⊙O于点A 2020-05-17 …
o野o既唔系咁容易伤心要分d辈分什么意思,怎么读粤语里会写道o野o既o什么的,怎么读,唔系咁容易伤 2020-06-26 …
如图,AB为圆O的直径,PB为O的切线,AC//OP,点C在圆O上,OP交圆O于D,DA交BC于G 2020-06-27 …
AB为圆O的直径,AB=AC,BC交圆O于点D,AC交圆O于点E,∠BAC=45°.给出下列结论① 2020-07-15 …
圆O与圆O'相交与A,B两点,过点B作CD垂直于AB,分别交圆O与圆O'于点C.D.(1)求证:A 2020-07-31 …