早教吧作业答案频道 -->化学-->
硼、镁及其化合物在工农业生产中应用广泛.已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程为:回答下列有关问题:(1)硼砂
题目详情
硼、镁及其化合物在工农业生产中应用广泛.
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程为:
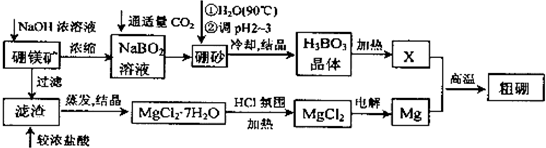
回答下列有关问题:
(1)硼砂溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为___.
H3BO3微溶于水,为一元弱酸,但其酸性并不是源于其结构中羟基的电离,请写出其电离方程式___.
(2)MgCl2•7H2O需要在HCl氛围中加热,其目的是___.若用惰性电极电解MgCl2溶液,其阴极反应式为___.
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则正极反应式为___.若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为___.已知Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=7时___(填“有”或“没有”)Mg(OH)2沉淀析出.
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼.现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol•L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL.盛装Na2S2O3溶液的仪器应为___滴定管(填“酸式”或“碱式”).该粗硼样品的纯度为___.(提示:I2+2S2O32-=2I-+S4O62-)
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为___.
H3BO3微溶于水,为一元弱酸,但其酸性并不是源于其结构中羟基的电离,请写出其电离方程式___.
(2)MgCl2•7H2O需要在HCl氛围中加热,其目的是___.若用惰性电极电解MgCl2溶液,其阴极反应式为___.
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则正极反应式为___.若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为___.已知Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=7时___(填“有”或“没有”)Mg(OH)2沉淀析出.
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼.现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol•L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL.盛装Na2S2O3溶液的仪器应为___滴定管(填“酸式”或“碱式”).该粗硼样品的纯度为___.(提示:I2+2S2O32-=2I-+S4O62-)
▼优质解答
答案和解析
(1)硼砂的化学式为Na2B4O7•10H2O,用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3,
H3BO3微溶于水,为一元弱酸,但其酸性并不是源于其结构中羟基的电离,应结合水电离生成OH-,促进水的电离,其电离方程式为H3BO3+H2O⇌B(OH)4-+H+,
故答案为:B4O72-+2H++5H2O=4H3BO3;H3BO3+H2O⇌B(OH)4-+H+;
(2)MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁;若用惰性电极电解MgCl2溶液,阴极氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,合并写出阴极反应式为:2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
故答案为:防止MgCl2水解生成Mg(OH)2;2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,正极上是过氧化氢得到电子生成水的反应,正极反应式H2O2+2H++2e-=2H2O;
若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,依据反应方程式得到c(Mg2+)=
c(H+)减小=0.045mol/L;
Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=7时,c(OH-)=10-7mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-14mol/L=4.5×10-16<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;
故答案为:H2O2+2H++2e-=2H2O;0.045 mol•L-1;没有;
(4)Na2S2O3溶液呈碱性,应放在碱式滴定管中,
硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,
根据关系式:B~BI3~
I2~3S2O32-,
n(B)=
n(S2O32-)=0.0018mol,
硼的质量为:10.81g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:
×100%=97.2%,
故答案为:碱式;97.2%.
H3BO3微溶于水,为一元弱酸,但其酸性并不是源于其结构中羟基的电离,应结合水电离生成OH-,促进水的电离,其电离方程式为H3BO3+H2O⇌B(OH)4-+H+,
故答案为:B4O72-+2H++5H2O=4H3BO3;H3BO3+H2O⇌B(OH)4-+H+;
(2)MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁;若用惰性电极电解MgCl2溶液,阴极氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,合并写出阴极反应式为:2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
故答案为:防止MgCl2水解生成Mg(OH)2;2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,正极上是过氧化氢得到电子生成水的反应,正极反应式H2O2+2H++2e-=2H2O;
若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,依据反应方程式得到c(Mg2+)=
| 1 |
| 2 |
Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=7时,c(OH-)=10-7mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-14mol/L=4.5×10-16<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;
故答案为:H2O2+2H++2e-=2H2O;0.045 mol•L-1;没有;
(4)Na2S2O3溶液呈碱性,应放在碱式滴定管中,
硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,
根据关系式:B~BI3~
| 3 |
| 2 |
n(B)=
| 1 |
| 3 |
硼的质量为:10.81g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:
| 0.01944g |
| 0.0200g |
故答案为:碱式;97.2%.
看了硼、镁及其化合物在工农业生产中...的网友还看了以下:
(1)方程sinx=x/10的根的个数为()A.7B.8C.9D.10(2)函数y=根号sin(c 2020-04-12 …
已知向量a=(mx,8),b=(2x+2,-x),c=(1,0),函数f(x)=a·b+1,g(x 2020-05-16 …
数学问题在平面直角坐标系xoy中.A(-1,0)B(0,2)C(2,0)(一)求过点C且与AB垂直 2020-06-04 …
解带字母的方程1.a+x/b=(x-b/a)+2(a≠0,b≠0)2.a(a+x)/b=b(b+x 2020-06-06 …
椭圆ab的取值1)焦点在X轴时,标准方程为:x^2/a^2+y^2/b^2=1(a>b>0)2)焦 2020-06-21 …
如果函数f(x)=x,a≤x≤b,f(x)=0,其他,是某连续型随机变量X的概率密度,则区间[a, 2020-07-22 …
1.用列举法表示下列集合B={x∈Z|(3-x)分之6∈Z}2.用描述法表示{(0,3)(3,0) 2020-08-01 …
高数向量代数和空间解几问题1,设向量a=(2,-1,-2),向量b=(1,1,z),问z为何值时向量 2020-10-31 …
假设股票A和股票B的预期收益和标准差分别为E(RA)=0.15,E(RB)=0.25,σA=0.1σ 2020-11-06 …
已知向量a和向量b是两个非零向量,且(向量a-向量b)垂直向量a,(向量b-2向量a)垂直于向量b, 2021-02-05 …