早教吧作业答案频道 -->化学-->
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH
题目详情
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
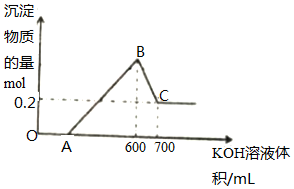
(1)OA对应反应的离子方程式为___,BC对应反应的离子方程式为___;
(2)c(KOH)=___mol/L,混合物中氧化铝的物质的量为___mol;
(3)A点对应的数值为___;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___.
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为___.

(1)OA对应反应的离子方程式为___,BC对应反应的离子方程式为___;
(2)c(KOH)=___mol/L,混合物中氧化铝的物质的量为___mol;
(3)A点对应的数值为___;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___.
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为___.
▼优质解答
答案和解析
由图可知,从开始至加入KOH溶液到A,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2KOH=K2SO4+2H2O;继续滴加KOH溶液,到氢氧化钾溶液为600mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,发生反应:3OH-+Al3+=Al(OH)3↓,2OH-+Mg2+=Mg(OH)2↓,溶液为硫酸钾溶液.再继续滴加KOH溶液,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,发生反应Al(OH)3+KOH=KAlO2+2H2O,沉淀部分溶解.
(1)OA段,氢氧化钾与硫酸反应生成硫酸钾和水,离子方程式:H++OH-=H2O;BC段,继续滴加KOH溶液,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,发生反应Al(OH)3+KOH=KAlO2+2H2O,离子方程式:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:H++OH-=H2O; Al(OH)3+OH-=AlO2-+2H2O;
(2)硫酸的物质的量为:0.3L×4mol/L=1.2mol,B点溶液为硫酸钾溶液,依据2K+~SO42-,则钾离子物质的量为2.4mol,即加入氢氧化钾物质的量为2.4mol,则氢氧化钾物质的量浓度为:2.4mol÷0.6L=4mol/L;
混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体,物质的量为
=0.3mol,由2Al~3H2↑,可知铝的物质的量为0.2mol,BC段消耗氢氧化钾物质的量为:0.1L×4mol/L=0.4mol,发生反应:Al(OH)3+OH-=AlO2-+2H2O,可知氢氧化铝物质的量为0.4mol,依据铝原子个数守恒,含有氧化铝的物质的量为:
=0.1mol;
故答案为:4;0.1;
(3)依据加入700mL氢氧化钾后沉淀物质的量为0.2mol,得溶液中含镁离子物质的量为0.2mol,沉淀镁离子消耗0.4mol氢氧化钾,沉淀0.4mol铝离子需要消耗氢氧化钾物质的量为0.4mol×3=1.2mol,所以OA段消耗氢氧化钾物质的量为:0.6L×4mol/L-0.4mol-1.2mol=0.8mol,消耗氢氧化钾体积:
=0.2L,即200mL;
故答案为:200;
(4)检验钾离子可以用焰色反应,透过蓝色钴玻璃观察,火焰呈紫色;
故答案为:透过蓝色钴玻璃观察,火焰呈紫色;
(5)C点溶液为偏铝酸钾溶液,通入足量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钾,反应的离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(1)OA段,氢氧化钾与硫酸反应生成硫酸钾和水,离子方程式:H++OH-=H2O;BC段,继续滴加KOH溶液,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,发生反应Al(OH)3+KOH=KAlO2+2H2O,离子方程式:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:H++OH-=H2O; Al(OH)3+OH-=AlO2-+2H2O;
(2)硫酸的物质的量为:0.3L×4mol/L=1.2mol,B点溶液为硫酸钾溶液,依据2K+~SO42-,则钾离子物质的量为2.4mol,即加入氢氧化钾物质的量为2.4mol,则氢氧化钾物质的量浓度为:2.4mol÷0.6L=4mol/L;
混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体,物质的量为
| 6.72L |
| 22.4L/mol |
| 0.4-0.2 |
| 2 |
故答案为:4;0.1;
(3)依据加入700mL氢氧化钾后沉淀物质的量为0.2mol,得溶液中含镁离子物质的量为0.2mol,沉淀镁离子消耗0.4mol氢氧化钾,沉淀0.4mol铝离子需要消耗氢氧化钾物质的量为0.4mol×3=1.2mol,所以OA段消耗氢氧化钾物质的量为:0.6L×4mol/L-0.4mol-1.2mol=0.8mol,消耗氢氧化钾体积:
| 0.8mol |
| 4mol/L |
故答案为:200;
(4)检验钾离子可以用焰色反应,透过蓝色钴玻璃观察,火焰呈紫色;
故答案为:透过蓝色钴玻璃观察,火焰呈紫色;
(5)C点溶液为偏铝酸钾溶液,通入足量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钾,反应的离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
看了 将一定量的铝粉、氧化铝、氧化...的网友还看了以下:
请问T=2×pi×w=2×pi×sqrt(m/k)中w^2=k/m的k和m代表的物理量含义是什么? 2020-05-13 …
(1)是否存在正整数m,n,使得m(m+2)=n(n+1)?(2)当k=3时,是否存在正整数m,n 2020-06-12 …
数学复习全书(数一)概率论中的条件概率求请教数一全书p540页书中说在X取特定值m时,Y的取值可能 2020-06-13 …
k边形有k条对角线,k为几边?过m边形的一个顶点画的对角线可以把多边形分成5个三角形,n边形没有对 2020-06-17 …
∑[k=0,∞]C(k,N)C(n-k,M-N)=C(n,M)∑[k=0,n](1-p)^k=1/ 2020-07-16 …
已知等差数列{an}的公差d>0,设{an}的前几项和为Sn,a1=1,S2×S3=36,求m,k 2020-07-17 …
反比例函数xy=k上p.q两点坐标分别为(m,k/m)(n,k/n)m小于n问p.q向x轴作垂线与x 2020-11-28 …
排列证明:P(m,n)=P(k,n)P(m-k,n-k)P(m,n)=n!/(n-m)!P(k,n) 2020-12-05 …
求所有的正整数m,n,以及整数k>1,满足下列条件:+2!+…+n!=m{k}(其中m{k}表示m的 2021-01-01 …
设M={α|α=k•90°,k∈Z}∪{α|α=k•180°+45°,k∈Z},N={α|α=k•4 2021-02-04 …