早教吧作业答案频道 -->化学-->
CO2与H2合成甲醚的主要反应如下:Ⅰ.2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1=-174.5kJ•mol-1.Ⅱ.CH3CH2OH(g)⇌CH3OCH3(g)△H2=+50.7kJ•mol-1回答下问题:(1)根据反应Ⅰ判断,1molCH3CH2OH(g
题目详情
CO2与H2合成甲醚的主要反应如下:
Ⅰ.2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1=-174.5kJ•mol-1.
Ⅱ.CH3CH2OH(g)⇌CH3OCH3(g)△H2=+50.7kJ•mol-1
回答下问题:
(1)根据反应Ⅰ判断,1molCH3CH2OH(g)完全燃烧比6molH2(g)完全燃烧放出的热量___(填“多”或“少”),反应Ⅱ中C-H键、C-O键的键能分别为413kJ•mol-1、343kJ•mol-1和465kJ•mol-1,则乙醇中C-C的键能为___kJ•mol-1.
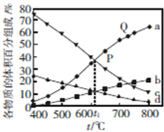
(2)在1L恒容密闭容器中投入0.1molCO2和0.3molH2,一定条件下发生反应Ⅰ,测得不同温度下平衡时各物质的体积百分组成与温度的关系如图所示.
①图中a、b、c、d表示的物质分别是___、___、___、___(填化学式).
②P、Q两点的逆反应速率:v逆(P)___v正(Q)(填“>”、“<”或“=”).
③t1℃时该反应的平衡常数K的值约为___.
(3)450℃时,CO2和H2按体积比1:3参加反应合成甲醚,压强越大平衡时甲醚的百分含量越___(填“高”或“低”),其原因是___.
Ⅰ.2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1=-174.5kJ•mol-1.
Ⅱ.CH3CH2OH(g)⇌CH3OCH3(g)△H2=+50.7kJ•mol-1
回答下问题:

(1)根据反应Ⅰ判断,1molCH3CH2OH(g)完全燃烧比6molH2(g)完全燃烧放出的热量___(填“多”或“少”),反应Ⅱ中C-H键、C-O键的键能分别为413kJ•mol-1、343kJ•mol-1和465kJ•mol-1,则乙醇中C-C的键能为___kJ•mol-1.
(2)在1L恒容密闭容器中投入0.1molCO2和0.3molH2,一定条件下发生反应Ⅰ,测得不同温度下平衡时各物质的体积百分组成与温度的关系如图所示.
①图中a、b、c、d表示的物质分别是___、___、___、___(填化学式).
②P、Q两点的逆反应速率:v逆(P)___v正(Q)(填“>”、“<”或“=”).
③t1℃时该反应的平衡常数K的值约为___.
(3)450℃时,CO2和H2按体积比1:3参加反应合成甲醚,压强越大平衡时甲醚的百分含量越___(填“高”或“低”),其原因是___.
▼优质解答
答案和解析
(1)已知:①2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l),
1molCH3CH2OH(g)完全燃烧的热化学方程式为②CH3CH2OH(g)+3O2(g)=2CO2(g)+3H2(l),
6molH2(g)完全燃烧的热化学方程式为③6H2(g)+3O2(g)=6H2O(l),①+②=③,①、②均为放热反应,故6molH2(g)完全燃烧放出的热量多;
设乙醇中C-C的键能为x,则CH3CH2OH(g)⇌CH3OCH3(g)△H2=413×5+x+343+465-6×413-2×343=+50.7,解得x=341.7;
故答案为:少;341.7;
(2)①反应Ⅰ是放热反应,升高温度,平衡逆向移动,则的CO2和H2体积分数增大,对应a或b,又氢气的含量比二氧化碳多,则a为氢气,b为二氧化碳;CH3CH2OH和3H2O的体积分数减小,对应c或d,生成的水蒸气含量多,则c为水,d为CH3CH2OH;
故答案为:H2;CO2;H2O;CH3CH2OH;
②温度高,反应速率快,v逆(P)正(Q);
故答案为:<;
③设反应二氧化碳2x,则,
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)
n始:0.1 0.3 0 0
n转:2x 6x x 3x
n平:0.1-2x 0.3-6x x 3x
t1℃时,氢气与水的体积分数相等,说明氢气与水平衡时的物质的量相同,则0.3-6x=3x,解得x=0.03,则化学平衡常数K=
=3×104;
故答案为:3×104;
(3)CO2和H2合成甲醚的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),该反应是个气体分子数减少的可逆反应,加压平衡正向移动,所以压强越大平衡时甲醚的百分含量越高;
故答案为:高;反应是个气体分子数减少的可逆反应,加压平衡正向移动.
1molCH3CH2OH(g)完全燃烧的热化学方程式为②CH3CH2OH(g)+3O2(g)=2CO2(g)+3H2(l),
6molH2(g)完全燃烧的热化学方程式为③6H2(g)+3O2(g)=6H2O(l),①+②=③,①、②均为放热反应,故6molH2(g)完全燃烧放出的热量多;
设乙醇中C-C的键能为x,则CH3CH2OH(g)⇌CH3OCH3(g)△H2=413×5+x+343+465-6×413-2×343=+50.7,解得x=341.7;
故答案为:少;341.7;
(2)①反应Ⅰ是放热反应,升高温度,平衡逆向移动,则的CO2和H2体积分数增大,对应a或b,又氢气的含量比二氧化碳多,则a为氢气,b为二氧化碳;CH3CH2OH和3H2O的体积分数减小,对应c或d,生成的水蒸气含量多,则c为水,d为CH3CH2OH;
故答案为:H2;CO2;H2O;CH3CH2OH;
②温度高,反应速率快,v逆(P)
故答案为:<;
③设反应二氧化碳2x,则,
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)
n始:0.1 0.3 0 0
n转:2x 6x x 3x
n平:0.1-2x 0.3-6x x 3x
t1℃时,氢气与水的体积分数相等,说明氢气与水平衡时的物质的量相同,则0.3-6x=3x,解得x=0.03,则化学平衡常数K=
| (3×0.03)3×0.03 |
| (0.1-2×0.03)2×(0.3-6×0.03)6 |
故答案为:3×104;
(3)CO2和H2合成甲醚的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),该反应是个气体分子数减少的可逆反应,加压平衡正向移动,所以压强越大平衡时甲醚的百分含量越高;
故答案为:高;反应是个气体分子数减少的可逆反应,加压平衡正向移动.
看了 CO2与H2合成甲醚的主要反...的网友还看了以下:
已知函数f(x)=sin(x-π/6)+cos(x-π/3).g(x)=2sin平方x/2.(1) 2020-05-16 …
如何判断浮力公式的使用浮力公式一共大概五个:1.F浮=G物2.F浮=F向上—F向下3.F浮=G-F 2020-05-16 …
已知函数y=f(x)和y=g(x)在[-2,2]的图像如图所示给出下列四个命题:①方程f[g(x) 2020-05-16 …
设函数f(x)=3次根号下(3x-2),g(x)=1/根号下(2x-3),求函数f(x)·g(x) 2020-06-25 …
已知A={x|x=m+n根号2,m,n∈z}1设x1=1/(3-4倍根号2),x2=根号下9-4倍 2020-08-01 …
设f(x)=根号3/2sin2x+1/2cos2x+1/2①写出函数f(x)的最小正周期,②若x属 2020-08-03 …
观察下列个等式:①根号下2又3分之2=2倍根号3分之2,②根号下3又8分之3=3倍根号8分之3③根号 2020-11-07 …
计算:2根号3*12的六次根*3/2的3次根感激涕零已知函数f(x)=(1/3)^x,函数为y=g( 2020-12-27 …
一.已知f(x)=x+1,g(x)=2^x,h(x)=-x+6,设函数F(x)=min{f(x),g 2020-12-31 …
设f(x)为定义在R上的增函数,令g(x)=f(x)-f(2014-x).(1)求证:g(x)+g( 2020-12-31 …