早教吧作业答案频道 -->化学-->
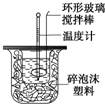
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL0.5mol/L盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.6mol/LNaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入
题目详情
利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.5mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.6mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):___.
(2)倒入NaOH溶液的正确操作是___(从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是___(从下列选出).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
②近似认为0.6mol/L NaOH溶液和0.6mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=___( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___.
a.实验装置保温、隔热效果差
b.将盐酸转移至小烧杯时洒了一部分在外面
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.

温度
实验次数 起始温度t1℃ 终止温度t2/℃ 温度差平均值 HCl NaOH 平均值 (t2-t1)/℃ 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 温度
实验次数 起始温度t1℃ 终止温度t2/℃ 温度差平均值 温度
实验次数
起始温度t1℃ 1终止温度t2/℃ 2温度差平均值 HCl NaOH 平均值 (t2-t1)/℃ HCl NaOH 平均值 (t2-t1)/℃ 21 1 26.2 26.0 26.1 29.5 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 33.3 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.2 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 4 26.4 26.2 26.3 29.8 3
①用量筒量取50mL 0.5mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.6mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:

(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):___.
(2)倒入NaOH溶液的正确操作是___(从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是___(从下列选出).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___.
a.实验装置保温、隔热效果差
b.将盐酸转移至小烧杯时洒了一部分在外面
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.

| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
实验次数
实验次数
实验次数
▼优质解答
答案和解析
(1)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-57.3 kJ/mol;
故答案为:HCl (aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-57.3 kJ/mol;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故选:C;
(3)使盐酸与NaOH溶液混合均匀的正确操作是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失;
故选:D;
(4)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据无效,其他三次温度差平均值为3.4℃,故答案为:3.4℃;
②50mL 0.5mol/L盐酸与50mL 0.6mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
1.4212kJ 0.025mol 1.4212kJ 1.4212kJ 1.4212kJ0.025mol 0.025mol 0.025mol=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
故答案为:HCl (aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-57.3 kJ/mol;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故选:C;
(3)使盐酸与NaOH溶液混合均匀的正确操作是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失;
故选:D;
(4)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据无效,其他三次温度差平均值为3.4℃,故答案为:3.4℃;
②50mL 0.5mol/L盐酸与50mL 0.6mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
看了 利用如图装置测定中和热的实验...的网友还看了以下:
下列实验操作正确的是()A、把水迅速倒入盛浓硫酸的烧杯里B、将量筒拿在水中,让视线与筒内凹液面保持 2020-04-07 …
用18mol/L浓硫酸配制100mL3.0mol/L稀硫酸的实验.回答下列问题:(1)所需浓硫酸的 2020-04-12 …
物理油膜估计分子直径油膜法估测分子直径中的油酸的体积怎么确定?就是那一滴油酸的体积怎么酸!书本上球 2020-05-13 …
你能算出下面每种冷饮各有多少吗?雪糕冰牛奶蛋筒每箱根每箱24瓶每箱5筒8箱6箱箱200根瓶800筒 2020-05-13 …
下列实验操作的描述中,正确的是()A.将稀盐酸滴到pH试纸上,并与标准比色卡比较,测定稀盐酸的pH 2020-05-13 …
小唐同学用98%的浓硫酸配制一定质量的10%的稀硫酸,在用量筒量取浓硫酸时,不恰当地俯视了读数.其 2020-05-14 …
右图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.计算:(要求写出简要计算过程)① 2020-05-14 …
鸡蛋壳的成分主要是碳酸钙.将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃筒中,可观察到鸡蛋一边冒气泡一边 2020-05-16 …
有一支10ml的量筒装满稀硫酸.把此量筒内的溶液全部倒入25ml的量筒中所得溶液的体积为何大于10 2020-05-16 …
取叶片数量和大小基本一致的6株幼小的凤仙花,分别插入6个相同的量筒内.量筒内加入同样量的清水,在水 2020-06-17 …