早教吧作业答案频道 -->化学-->
亚氯酸钠(NaClO2)是一种高效漂白剂和强氧化剂.某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:回答下列问题:(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧
题目详情
亚氯酸钠(NaClO2)是一种高效漂白剂和强氧化剂.
某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:
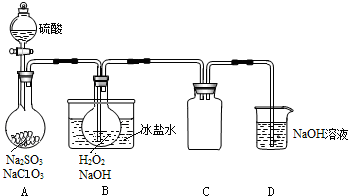
回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、___、___.
(2)实验须使NaClO3稍微过量,目的是___.
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意___.
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,则另一种为___.
(5)B中反应的离子方程式为___.
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入___(填序号,下同)酸化,再加入___检验.
①稀HNO3 ②稀H2SO4 ③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)装置C的作用是___.
(8)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO2•3H2O,至少需___ g NaClO3.
(9)NaClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某污水中含CN-a mg/L,现用NaClO2将CN-氧化,只生成两种无毒气体.处理100m3这种污水,至少需要NaClO2___ mol.
某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:

回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、___、___.
(2)实验须使NaClO3稍微过量,目的是___.
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意___.
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,则另一种为___.
(5)B中反应的离子方程式为___.
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入___(填序号,下同)酸化,再加入___检验.
①稀HNO3 ②稀H2SO4 ③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)装置C的作用是___.
(8)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO2•3H2O,至少需___ g NaClO3.
(9)NaClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某污水中含CN-a mg/L,现用NaClO2将CN-氧化,只生成两种无毒气体.处理100m3这种污水,至少需要NaClO2___ mol.
▼优质解答
答案和解析
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、量筒、天平,故答案为:量筒;天平;
(2)亚硫酸钠和NaClO3均会和硫酸发生反应,实验须使NaClO3稍微过量,其目的是使Na2SO3完全反应,避免产生SO2气体,
故答案为:使Na2SO3完全反应,避免产生SO2气体;
(3)为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率,可以控制硫酸的滴入速度,故答案为:控制硫酸的滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,
故答案为:ClO3-;
(5)ClO2气体在碱性环境下能将过氧化氢氧化,得到ClO2-,B中反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,故答案为:②;⑤⑥;
(7)装置C的作用是防倒吸,故答案为:防倒吸;
(8)28.9 g NaClO2•3H2O的物质的量是
=0.2mol,根据钠元素守恒需要的NaClO3的物质的量是
=0.25mol,所以需要NaClO3的质量是0.25mol×106.5g/mol≈26.6g,故答案为:26.6;
(9)用ClO2将CN-氧化,生成氮气和二氧化碳两种无毒气体的化学方程式为2ClO2+2CN-=2CO2+2Cl-+N2↑,amg/L这种污水中含有CN-的质量是100ag,CN-的物质的量为
=
mol,所以需要ClO2的物质的量是
mol,故答案为:
.
(2)亚硫酸钠和NaClO3均会和硫酸发生反应,实验须使NaClO3稍微过量,其目的是使Na2SO3完全反应,避免产生SO2气体,
故答案为:使Na2SO3完全反应,避免产生SO2气体;
(3)为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率,可以控制硫酸的滴入速度,故答案为:控制硫酸的滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,
故答案为:ClO3-;
(5)ClO2气体在碱性环境下能将过氧化氢氧化,得到ClO2-,B中反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,故答案为:②;⑤⑥;
(7)装置C的作用是防倒吸,故答案为:防倒吸;
(8)28.9 g NaClO2•3H2O的物质的量是
| 28.9g |
| 144.5g/mol |
| 0.2mol |
| 80% |
(9)用ClO2将CN-氧化,生成氮气和二氧化碳两种无毒气体的化学方程式为2ClO2+2CN-=2CO2+2Cl-+N2↑,amg/L这种污水中含有CN-的质量是100ag,CN-的物质的量为
| 100ag |
| 26g/mol |
| 50a |
| 13 |
| 50a |
| 13 |
| 50a |
| 13 |
看了亚氯酸钠(NaClO2)是一种...的网友还看了以下:
(1)证明:不论a取什么值,直线L:y=ax-a都通过一个定点;(2)以A(0,2)、B(2,0) 2020-05-16 …
圆和直线方程已知直线l的方程为x-y+2根号2=0,圆的方程为x+y=1(1)若Q为圆O上任一 2020-05-17 …
已知椭圆C:x^2/a^2+y^2/b^2=1(a>b>0)已知椭圆C:x^2/a^2+y^2/b 2020-06-14 …
已知f(x+2)=f(x),且f(x)={x,-1≮x≮o-xˆ2,0﹤x≮1求f(5)的值 2020-07-09 …
在平面直角坐标系中,圆o:x^2+y^2=4,直线l:12x-5y+c=0.(1)若xy满足方程x 2020-07-12 …
已知双曲线c:x^2/a^2-y^2/b^2=1(a>0,b>0)的两个焦点为f1(-2,0),f 2020-07-14 …
在平面直角坐标系中xoy中,已知圆O:x^2+y^2=64,圆O1与圆O2相交,圆心为O1(9,0 2020-07-17 …
过点p(3.4)的直线l在y轴上的截距为71求直线l的方程,2求过o(5,0)且和直线l平过点p( 2020-07-30 …
已知圆O:x^2+y^2=4,点P为直线l:x=4上的动点.若点A(-2,0),B(2,0),直线 2020-07-30 …
表格公式ROUND(T5+W5+X5+Y5+Z5+AA5+AB5+AC5+AD5-$L$2*0.8/ 2020-10-31 …