常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )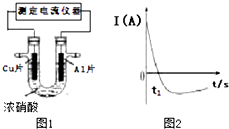
A. 0-t1时,正极的电极反应式为:2H++NO3--e-═NO2+H2O
B. 0-t1时,溶液中的H+向Cu电极移动
C. t1时,负极的电极反应式为:Cu-2e-═Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
B.0-t1时,铜为正极,溶液中的H+向Cu电极移动,故B正确;
C.t1时,铜做负极反应,Al为正极,负极发生Cu-2e-=Cu2+,故C正确;
D.随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜做负极反应,电流方向相反,故D正确.
故选A.
易如反掌的造句 2020-04-06 …
不属于胃食管反流的病因是A.下食管括约肌张力低下B.胃排空加快C.频发的下食管括约肌一过性松弛D. 2020-06-04 …
胃食管反流的检测方法不包括A.食管钡剂造影B.胸部X线片C.食管测压D.食管pH监测E.食管放射性核 2020-06-04 …
以下哪项不是小儿胃食管反流的发病原因A.下食管括约肌张力低B.食管、胃夹角大C.幽门括约肌发育成 2020-06-04 …
胃食管反流的主要症状是A.恶心B.呕吐C.腹胀D.上腹痛E.消化道出血 2020-06-04 …
筛查膀胱输尿管反流的重要手段是A.血尿素氮升高B.血肌酐升高C.内生肌酐清除率下降D.B型超声检查E 2020-06-04 …
持续食物过敏是日后发生A.消化道溃疡的危险因素B.胃一食管反流的危险因素C.过敏性疾病的危险因素 2020-06-06 …
视而不见和易如反掌的意思 2020-06-06 …
视而不见,易如反掌的意思 2020-06-06 …
易如反掌的意思是什么?易如反掌的意思是什么,我很急,请快一点 2020-06-06 …