早教吧作业答案频道 -->化学-->
表是几种常见弱酸的电离平衡常数(25℃).酸电离方程式电离平衡常数KCH3COOHCH3COOH⇌CH3COO-+H+1.75×10-5H2CO3H2CO3⇌H++HCO3-HCO3-⇌H++CO32-K1=4.4×10-7K2=4.7×10-11
题目详情
表是几种常见弱酸的电离平衡常数(25℃).
回答下列各题
(1)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系是:___.
(2)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是___,最弱的是___.
(3)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,即K1》K2》K3,产生此规律的原因是___.
(4)某温度(T℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则
①该温度下水的Kw=___.
②该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,所得溶液为___.(填“酸性”、“中性”或“碱性”)
(5)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
.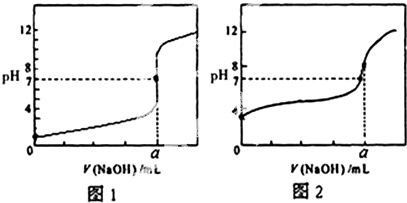
①NaOH溶液滴定CH3COOH溶液的曲线是___(填“图1”或“图2”);
②a=___mL.
③该实验操作所需的主要玻璃仪器有:酸式滴定管、___、锥形瓶.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH⇌CH3COO-+H+ | 1.75×10-5 |
| H2CO3 | H2CO3⇌H++HCO3- HCO3-⇌H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S⇌H++HS- HS-⇌H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4⇌H++H2PO4- H2PO4-⇌H++HPO42- HPO42-⇌H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系是:___.
(2)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是___,最弱的是___.
(3)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,即K1》K2》K3,产生此规律的原因是___.
(4)某温度(T℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则
①该温度下水的Kw=___.
②该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,所得溶液为___.(填“酸性”、“中性”或“碱性”)
(5)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
.

①NaOH溶液滴定CH3COOH溶液的曲线是___(填“图1”或“图2”);
②a=___mL.
③该实验操作所需的主要玻璃仪器有:酸式滴定管、___、锥形瓶.
▼优质解答
答案和解析
(1)相同条件下,K值越大,说明该酸的电离程度越大,则溶液中氢离子浓度越大,溶液的酸性越强,
故答案为:相同条件下K值越大,电离出的氢离子浓度越大,酸性越强;
(2)酸的电离平衡常数越大,其酸性越强,根据电离平衡常数知,酸性最强的是H3PO4,最弱的是HS-,
故答案为:H3PO4;HS-;
(3)同一多元弱酸每一步都电离出氢离子,上一级电离产生的H+对下一级电离有抑制作用,所以K1、K2、K3之间存在着数量上的规律为K1》K2》K3,
故答案为:上一级电离产生的H+对下一级电离有抑制作用;
(4)①某温度时,测得0.01mol•L-1的NaOH 溶液pH=11,该溶液中NaOH是强电解质,在水溶液中完全电离,根据氢氧根离子守恒得c(NaOH)=c(OH-)=0.01mol/L,该溶液中c(H+)=10-11mol/L,水的离子积(KW)=c(OH-).c(H+)=0.01×10-11=10-13,
故答案为:1×10-13;
②该温度下,KW=1×10-13,pH=2的盐酸和pH=11的氢氧化钠溶液中氢离子浓度与氢氧根离子浓度相同,等体积混合后所得溶液显中性,故答案为:中性;
(5)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定醋酸的曲线是图2,故答案为:图2;
②HCl与NaOH反应时,物质的量之比为1:1,等浓度的盐酸和氢氧化钠中和时,其溶液体积比为1:1,所以a=20.00mL,故答案为:20.00;
③酸碱中和滴定中所用的主要玻璃仪器有酸式滴定管、碱式滴定管和锥形瓶,故答案为:碱式滴定管.
故答案为:相同条件下K值越大,电离出的氢离子浓度越大,酸性越强;
(2)酸的电离平衡常数越大,其酸性越强,根据电离平衡常数知,酸性最强的是H3PO4,最弱的是HS-,
故答案为:H3PO4;HS-;
(3)同一多元弱酸每一步都电离出氢离子,上一级电离产生的H+对下一级电离有抑制作用,所以K1、K2、K3之间存在着数量上的规律为K1》K2》K3,
故答案为:上一级电离产生的H+对下一级电离有抑制作用;
(4)①某温度时,测得0.01mol•L-1的NaOH 溶液pH=11,该溶液中NaOH是强电解质,在水溶液中完全电离,根据氢氧根离子守恒得c(NaOH)=c(OH-)=0.01mol/L,该溶液中c(H+)=10-11mol/L,水的离子积(KW)=c(OH-).c(H+)=0.01×10-11=10-13,
故答案为:1×10-13;
②该温度下,KW=1×10-13,pH=2的盐酸和pH=11的氢氧化钠溶液中氢离子浓度与氢氧根离子浓度相同,等体积混合后所得溶液显中性,故答案为:中性;
(5)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定醋酸的曲线是图2,故答案为:图2;
②HCl与NaOH反应时,物质的量之比为1:1,等浓度的盐酸和氢氧化钠中和时,其溶液体积比为1:1,所以a=20.00mL,故答案为:20.00;
③酸碱中和滴定中所用的主要玻璃仪器有酸式滴定管、碱式滴定管和锥形瓶,故答案为:碱式滴定管.
看了 表是几种常见弱酸的电离平衡常...的网友还看了以下:
问几个c问题1,设x=2.5,y=4.7,a=7,则x+a%3*(int)(x+y)%2/4=2, 2020-04-08 …
已知△ABC的三个顶点分别为A(2,3),B(-1,-2)C(-3,4),求已知三角形ABC的三个 2020-05-16 …
某同学有同样画册2本,同样的集邮册3本,从中取出4本送给4位同学,每人一本,共有几种不同的赠送方法 2020-05-22 …
初学行列式,请帮我证明两道题,|ax+byay+bzza+bx||xyz|1、证明:|ay+bza 2020-06-11 …
1.已知a,b,c是正有理数.求证:a^3/(a^2+ab+b^2)+b^3/(b^2+bc+c^ 2020-06-12 …
对任意有理数x.y定义运算如下x△y=ax+by+cxy,这里a.b.c是给定的数,等式右边是通常 2020-06-14 …
求下列行列式的值|a2(a+1)2(a+2)2(a+3)2||b2(b+1)2(b+2)2(b+3 2020-07-09 …
求证下面的行列式等于0|a^2(a+1)^2(a+2)^2(a+3)^2||b^2(b+1)^2( 2020-07-10 …
若“!”是一种数学运算符号,并且1!=1,=2×1=2,=3×2×1=6,=4×3×2×1=24,… 2020-11-20 …
若(a+1)^2+(2b-4)^2+|c+3/2|=0,试求ab+bc+ac的值若(a+b)^2+( 2020-12-13 …