早教吧作业答案频道 -->化学-->
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
题目详情
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
…
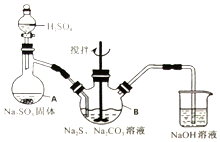
(1)写出仪器A的名称___.
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因___.
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式___.
(4)从上述生成物混合液中获得较高产率Na2S2O3•5H2O的步骤为:
向反应混合液加活性炭脱色
滤液
粗晶体
为减少产品的损失,操作①为趁热过滤,“趁热”的原因是___;操作②是___;操作①是抽滤、洗涤、干燥.
(5)测定产品纯度
取6.00g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为00.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-.相关数据记录如表所示.
滴定时,达到滴定终点的现象是___.产品的纯度为___.
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为___.
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
…

(1)写出仪器A的名称___.
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因___.
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式___.
(4)从上述生成物混合液中获得较高产率Na2S2O3•5H2O的步骤为:
向反应混合液加活性炭脱色
| 操作① |
| |
| 操作② |
| |
| 操作 |
| |
| ③ |
为减少产品的损失,操作①为趁热过滤,“趁热”的原因是___;操作②是___;操作①是抽滤、洗涤、干燥.
(5)测定产品纯度
取6.00g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为00.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-.相关数据记录如表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为___.
▼优质解答
答案和解析
(1)仪器A为蒸馏烧瓶;
故答案为;蒸馏烧瓶;
(2)Na2S2O3在酸性条件下会生成S和二氧化硫,产率会下降,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑;
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)二氧化硫与硫化钠、碳酸钠反应生成Na2S2O3和二氧化碳,反应为4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
故答案为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
(4)从上述生成物混合液中获得较高产率Na2S2O3▪5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3▪5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶;
故答案为:为了防止晶体在漏斗中大量析出导致产率降低;蒸发浓缩,冷却结晶;
(5)淀粉溶液作指示剂,用度为0.500mol/LI2的标准溶液进行滴定溶液中的碘,滴定终点时溶液由无色变蓝色,且半分钟不褪色;
第二组实验数据相差较大,舍去,故消耗标准液的体积为(19.98+20.02)mL÷2=20.00mL,2S2O32-~I2,则n(Na2S2O3•5H2O)=2n(I2),故产品纯度为:
×100%=82.67%;
故答案为:溶液由无色变蓝色,且半分钟不褪色;82.67%;
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,硫元素化合价升高,则氯元素化合价降低,生成氯离子,离子反应为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
故答案为;蒸馏烧瓶;
(2)Na2S2O3在酸性条件下会生成S和二氧化硫,产率会下降,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑;
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)二氧化硫与硫化钠、碳酸钠反应生成Na2S2O3和二氧化碳,反应为4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
故答案为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
(4)从上述生成物混合液中获得较高产率Na2S2O3▪5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3▪5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶;
故答案为:为了防止晶体在漏斗中大量析出导致产率降低;蒸发浓缩,冷却结晶;
(5)淀粉溶液作指示剂,用度为0.500mol/LI2的标准溶液进行滴定溶液中的碘,滴定终点时溶液由无色变蓝色,且半分钟不褪色;
第二组实验数据相差较大,舍去,故消耗标准液的体积为(19.98+20.02)mL÷2=20.00mL,2S2O32-~I2,则n(Na2S2O3•5H2O)=2n(I2),故产品纯度为:
20.00mL×10-3×0.5mol/L×2×
| ||
| 6g |
故答案为:溶液由无色变蓝色,且半分钟不褪色;82.67%;
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,硫元素化合价升高,则氯元素化合价降低,生成氯离子,离子反应为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
看了硫代硫酸钠(Na2S2O3•5...的网友还看了以下:
读语句画图并解答1、画线段AB=3.2、取线段AB的中点O.3、过点O画直线CD,使∠COA=90 2020-05-12 …
(1)操作、观察:任意画⊙O,在⊙O内任取一点P(不为圆心),过点P直线l,交⊙O于点A、B.若直 2020-05-13 …
平面直角坐标系的原点为O,在抛物线y=1/2x^2上取一点P,在x轴上取一点A,使OP=PA,平面 2020-05-16 …
一个袋中有4个不同的红球,6个不同的白球.1)从中任取4哥球,红不少于白的取法有几种2)若取红记2 2020-05-23 …
试用迭代法给出方程x3-x-2=0,在2附近的五次迭代近似解,即由x.o=2算出x.5,精确到小数 2020-06-22 …
如图,在半径为1的⊙O上任取一点A,连续以1为半径在⊙O上截取AB=BC=CD,分别以A、D为圆心 2020-07-22 …
求给以下算法复杂度排序增长速度由慢到快1)O(n^(3/4))O(log(n)^5)O(2^n)O 2020-07-23 …
如图,已知AB是⊙O的直径,BC是⊙O的切线,OC与⊙O相交于点D,连接AD并延长与BC相交于点E 2020-07-24 …
函数y=x22x+3在[o,m]上最大值为3,则m的取值范围为?当x属于[0,2]时,函数f(x)= 2020-12-08 …
算法的时间复杂度分析中,O(2^n)与O(n!)哪个增长速度快?书上写的O(2^n) 2021-01-14 …