早教吧作业答案频道 -->化学-->
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
题目详情
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为___.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为___.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
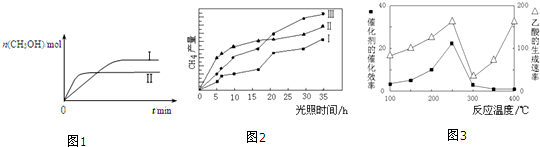
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H___0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为___.
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在___范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式___.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为___.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为___.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H___0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在___范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式___.
▼优质解答
答案和解析
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0,根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ,
故答案为:小于;>;
②设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
开始1(mol):1 3 0 0
变化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a 3a b b
则由题意可知:
=0.8,解得x=0.4,
根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+b=1,要使反应始终向逆向进行,则b>x,故a的范围为小于等于1大于0.4,
故答案为:0.4<b≤1;
(4)根据图象3可知,当温度大于300℃时,线的斜率变化较大,也就是温度对化学反应速率的影响较大,故答案为:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0,根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ,
故答案为:小于;>;
②设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
开始1(mol):1 3 0 0
变化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a 3a b b
则由题意可知:
| x+x+1-x+3-3x |
| 1+3 |
根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+b=1,要使反应始终向逆向进行,则b>x,故a的范围为小于等于1大于0.4,
故答案为:0.4<b≤1;
(4)根据图象3可知,当温度大于300℃时,线的斜率变化较大,也就是温度对化学反应速率的影响较大,故答案为:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
看了研究和深度开发CO、CO2的应...的网友还看了以下:
30'N,75'E位于0',20'W的什么方向?拜托真的很急 2020-05-13 …
高数 设数列{xn}的一般项sn=1/n cos (npai)/2,求出N 使得当n>N时,xn与 2020-05-16 …
以下几种叙述与极限lim an=a的定义是否等价,说明理由1)任意e大于0,有无限多个an,有|a 2020-05-21 …
若a大于b大于0,c小于d小于0,e小于0求证,(a-c)的平方/e大于(b-d)的平方/e 2020-06-03 …
若a大于b大于0,c小于d小于0,e小于0,求证(a减c)的平方分之e大于(b减d)平方分之e,考 2020-06-03 …
请大神来做一道中值证明题f(x)在[0,a]上连续,在(0,a)内可导,且f(a)等于0,证明存在 2020-06-14 …
设E是直线上衣有界集合,m*E大于0,则对于任意小于m*E的正数c.恒有E的子集E1,使得m*E1 2020-06-23 …
n阶方阵A满足A^2=O,E是n阶单位阵,则A.|E-A|≠0,但|E+A|=0B|E-An阶方阵A 2020-11-02 …
应用能斯特方程计算出电池E小于0,这表示电池的反应A不可能进行B反应以达平衡C反应能进行,但和电池的 2021-01-01 …
如图点0在角APB的角平分线上圆0与PA相切于点C求证直线PB与圆O相切,PO的延长线与圆0交于点E 2021-01-11 …