早教吧作业答案频道 -->化学-->
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g
题目详情
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2=___.
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0
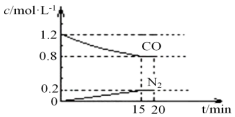
在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.
①0~15min 内,v(CO2)=___,25℃时该反应平衡常数为___(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是___(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3.已知NaHSO3溶液同时存在以下两种平衡:
①HSO3-⇌SO32-+H+,②HSO3-+H2O⇌H2SO3+OH-;常温下,0.l mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)___c(SO32-)(填“>”、“=”或“<”).

(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2=___.
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0
在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.
①0~15min 内,v(CO2)=___,25℃时该反应平衡常数为___(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是___(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3.已知NaHSO3溶液同时存在以下两种平衡:
①HSO3-⇌SO32-+H+,②HSO3-+H2O⇌H2SO3+OH-;常温下,0.l mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)___c(SO32-)(填“>”、“=”或“<”).
▼优质解答
答案和解析
(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+
SO2(g)=
S(s)+CO2(g)△H=-135kJ/mol,故答案为:CO(g)+
SO2(g)=
S(s)+CO2(g)△H=-135kJ/mol;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1,则(-574KJ•mol-1+△H2)×
=-867KJ•mol-1,
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol;
(3)①v(CO)=
=
=0.027 mol∙L-1∙min-1;所以v(CO2)=v(CO)=0.027 mol∙L-1∙min-1;
2NO(g)+2CO(g)⇌N2(g)+2CO2(g),
初起:1 1.2 0 0
变化:0.4 0.4 0.4 0.4
平衡:0.6 0.8 0.4 0.4
所以K=
=0.14,故答案为:0.027 mol∙L-1∙min-1; 0.14;
②a.升高温度平衡逆向移动,导致NO浓度增加,故符合; b.增加CO的量,平衡正向移动,导致NO浓度下降,故不符合; c.降低温度,平衡正向移动,导致NO浓度下降,故不符合; d.扩大容积平衡逆向移动,但导致NO浓度下降,故不符合;故选:a;
(4)已知NaHSO3中的HSO3-既能电离又能水 HSO3-⇌H++SO32-电离显酸性,HSO3-+H2O⇌H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),故答案为:<.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×
| 1 |
| 2 |
| 1 |
| 2 |
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol;
(3)①v(CO)=
| △c |
| △t |
| (1.2-0.8)mol/L |
| 15min |
2NO(g)+2CO(g)⇌N2(g)+2CO2(g),
初起:1 1.2 0 0
变化:0.4 0.4 0.4 0.4
平衡:0.6 0.8 0.4 0.4
所以K=
| 0.42×0.4 |
| 0.62×0.82 |
②a.升高温度平衡逆向移动,导致NO浓度增加,故符合; b.增加CO的量,平衡正向移动,导致NO浓度下降,故不符合; c.降低温度,平衡正向移动,导致NO浓度下降,故不符合; d.扩大容积平衡逆向移动,但导致NO浓度下降,故不符合;故选:a;
(4)已知NaHSO3中的HSO3-既能电离又能水 HSO3-⇌H++SO32-电离显酸性,HSO3-+H2O⇌H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),故答案为:<.
看了研究NOx、SO2、CO等大气...的网友还看了以下:
石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:(1)石碱中N 2020-05-15 …
如图,在Rt△ABC中,∠ACB=90°AO是△ABC的角平分线.以O为圆心,OC为半径作O.(1 2020-06-13 …
飞行员的有一项体检标准不太懂15.1任何一眼裸眼远视力低于o.7不合格。任何一眼裸眼远视力不低于o 2020-07-06 …
(1)在压强为O.1MPa条件下,容积为VL的密闭容器中,amolCO与2amolH2在催化剂作用 2020-07-22 …
用竖式计算,并验算.①6.8÷o.h②4.6÷1.h③h.4÷o.18④h.h8÷8.6⑤h.98 2020-07-29 …
(1)如图1,在平行四边形ABCD中,将△BCD沿BD翻折,使点C落在点E处,BE和AD相交于点O 2020-07-31 …
[惊人发现]1=O.9循环1=O.9循环∵1/3=O.3循环∴1/3+1/3=O.3循环+O.3循环 2020-10-31 …
通过计算前三个算式,找出规律后把其他算式补充完整,再用计算器检验.2.1×O.9÷0.1=3.21× 2021-01-01 …
数据结构试题一、单项选择题(10)1、若长度为n的线性表采用顺序存储结构,在其第i个位置插入一个新元 2021-01-14 …
设n阶幂零矩阵A的秩为r,求证:Ar+1=O. 2021-02-10 …