早教吧作业答案频道 -->化学-->
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4•2H2O工艺流程如图:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、M
题目详情
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4•2H2O工艺流程如图:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的主要目的是___.
(2)向浸出液中加入NaClO3的离子反应方程式:___.
(3)已知:常温下
NH3•H2O⇌NH4++OH- Kb=1.8×10-5
H2C2O4⇌H++HC2O4- Ka1=5.4×10-2
HC2O4-⇌H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”).
(4)加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:___.
A.蒸馏水B.自来水C.饱和的(NH4)2C2O4溶液D.稀盐酸
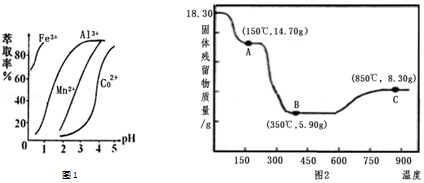
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是___;其使用的适宜pH范围是___.
A.2.0~2.5B.3.0~3.5C.4.0~4.5
(6)CoC2O4•2H2O热分解质量变化过程如图2所示.其中600℃以前是隔绝空气加热,600℃以后是在空气中加热.A、B、C均为纯净物;C点所示产物的化学式是___.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)向浸出液中加入NaClO3的离子反应方程式:___.
(3)已知:常温下
NH3•H2O⇌NH4++OH- Kb=1.8×10-5
H2C2O4⇌H++HC2O4- Ka1=5.4×10-2
HC2O4-⇌H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”).
(4)加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:___.
A.蒸馏水B.自来水C.饱和的(NH4)2C2O4溶液D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是___;其使用的适宜pH范围是___.
A.2.0~2.5B.3.0~3.5C.4.0~4.5
(6)CoC2O4•2H2O热分解质量变化过程如图2所示.其中600℃以前是隔绝空气加热,600℃以后是在空气中加热.A、B、C均为纯净物;C点所示产物的化学式是___.

▼优质解答
答案和解析
含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,
故答案为:将Co3+、Fe3+还原为Co2+、Fe2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)盐类水解,谁强显谁性,NH3•H2O⇌NH4++OH- Kb=1.8×10-5,HCO4-⇌H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(4)为洗涤晶体附着的离子,同时不引入新的杂质离子,过滤获得晶体洗涤时,可直接选用蒸馏水洗涤,故答案为:A.
(5)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳,
故答案为:除去溶液中的Mn2+;B;
(6)由图可知,C点钴氧化物质量为8.30g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.30g-5.9g=2.40g,则氧化物中Co原子与O原子物质的量之比为0.1mol:
≈2:3,故C的Co氧化物为Co2O3,
故答案为:Co2O3.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,
故答案为:将Co3+、Fe3+还原为Co2+、Fe2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)盐类水解,谁强显谁性,NH3•H2O⇌NH4++OH- Kb=1.8×10-5,HCO4-⇌H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(4)为洗涤晶体附着的离子,同时不引入新的杂质离子,过滤获得晶体洗涤时,可直接选用蒸馏水洗涤,故答案为:A.
(5)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳,
故答案为:除去溶液中的Mn2+;B;
(6)由图可知,C点钴氧化物质量为8.30g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.30g-5.9g=2.40g,则氧化物中Co原子与O原子物质的量之比为0.1mol:
| 2.40 |
| 16g/mol |
故答案为:Co2O3.
看了草酸钴可用于指示剂和催化剂的制...的网友还看了以下:
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、M 2020-05-13 …
1、相等质量的CO和CO2中所含的氧元素的质量比是多少2、含相等质量氧元素的CO和CO2的质量比是 2020-05-22 …
CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还 2020-06-30 …
草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、A 2020-11-01 …
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、Mn 2020-11-01 …
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、Mn 2020-11-01 …
草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、Mn 2020-11-01 …
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO 2020-11-02 …
(2014•天津模拟)已知CO2是限制植物光合作用强度的重要环境因素之一,在农业生产中往往需要采取一 2020-11-12 …
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇.用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 2020-11-20 …