早教吧作业答案频道 -->化学-->
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如图1:(1)溶溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是.(2)氧化:加热搅拌条件下加入NaClO3
题目详情
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如图1:
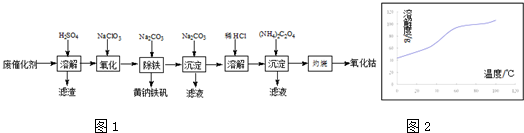
(1)溶 溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___.
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式___.
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是___.(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式___.
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是___.
(5)溶 CoCl2的溶解度曲线如图2所示.向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___.
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式___.

(1)溶 溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___.
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式___.
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是___.(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式___.
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是___.
(5)溶 CoCl2的溶解度曲线如图2所示.向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___.
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式___.
▼优质解答
答案和解析
钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)2•3Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)2•3Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后燃烧生成氧化钴,
(1)洗液与滤液合并,可提高洗涤和滤液中钴的利用率,
故答案为:提高钴等元素的利用率;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-
6Fe3++Cl-+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化,
故答案为:6Fe2++6H++ClO3-
6Fe3++Cl-+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;
(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,
故答案为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑;
(4)沉淀洗涤的方法是:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次,
故答案为:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;
(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出,
故答案为:防止因温度降低,CoCl2晶体析出;
(6)CoC2O4的质量为1.470g,其我知道可为0.01mol,Co元素质量为0.59g,钴氧化物质量为0.83g,氧化物中氧元素质量为:0.83g-0.59g=0.24g,则氧化物中Co原子与O原子物质的量之比为0.01mol:
≈2:3,故Co氧化物为Co2O3,
故答案为:Co2O3.
(1)洗液与滤液合并,可提高洗涤和滤液中钴的利用率,
故答案为:提高钴等元素的利用率;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-
| ||
故答案为:6Fe2++6H++ClO3-
| ||
(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,
故答案为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑;
(4)沉淀洗涤的方法是:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次,
故答案为:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;
(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出,
故答案为:防止因温度降低,CoCl2晶体析出;
(6)CoC2O4的质量为1.470g,其我知道可为0.01mol,Co元素质量为0.59g,钴氧化物质量为0.83g,氧化物中氧元素质量为:0.83g-0.59g=0.24g,则氧化物中Co原子与O原子物质的量之比为0.01mol:
| 0.24 |
| 16 |
故答案为:Co2O3.
看了以含钴废催化剂(主要成分为Co...的网友还看了以下:
当棉花枝繁叶茂时整枝,减去多余部分的目的是什么 2020-04-06 …
给下面一段打乱顺序的语句排序,正确的一项是()①差分的目的是消除公共误差,提高定位精度。②为了减少 2020-05-13 …
材料分析题阅读下列材料:材料一材料二全面建设小康社会,是21世纪头20年我国的奋斗目标,是实现现代 2020-05-14 …
约分的依据是()约分的目的是()分数 2020-05-16 …
企业进行市场细分的目的是( )。 A.实现企业使命 B.选择分销渠道 C.选择目标市场 D.实施营销 2020-05-30 …
按使用对象划分的目录是( )。A.馆藏目录B.中文目录C.读者目录D.标准目录 2020-05-31 …
配置台配置的数据在系统中分别存放在什么位置,并叙述CCS.INI与ICD.INI有何区别及进行区分的 2020-05-31 …
选词填空正确的一项是()这张肥胖但很的脸的下半部覆盖着得很短的胡须,黑色眼睛早然近视,但透着十分的 2020-06-28 …
工程上流水段划分的目的是什么? 2020-11-11 …
(12分)阅读材料,完成题目要求。材料:高中历史教材必修II部分章节目录对比根据上表所提供的两个版本 2020-11-23 …