早教吧作业答案频道 -->化学-->
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0(1)氮氧化物破坏
题目详情
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0
(1)氮氧化物破坏臭氧层原理为:①NO+O3⇌NO2+O2 ②NO2+O⇌NO+O2
常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O⇌2O2的平衡常数K=___(用K1、K2表示).氮氧化物在该反应中的作用是___.
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是___、___.该法可能发生副反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),减少副反应的主要措施是___、___.
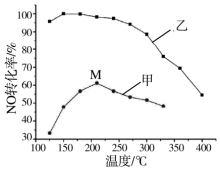
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图.
①工业上选择催化剂乙的原因是___;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率.高于210℃时,NO转化率降低的原因可能是___.
(4)消除汽车尾气中的NO时,可用尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分.与SCR法相比,等物质的量的尿素与氨气可消除的NO物质的量之比为___.(不考虑副反应)

(1)氮氧化物破坏臭氧层原理为:①NO+O3⇌NO2+O2 ②NO2+O⇌NO+O2
常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O⇌2O2的平衡常数K=___(用K1、K2表示).氮氧化物在该反应中的作用是___.
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是___、___.该法可能发生副反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),减少副反应的主要措施是___、___.
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图.
①工业上选择催化剂乙的原因是___;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率.高于210℃时,NO转化率降低的原因可能是___.
(4)消除汽车尾气中的NO时,可用尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分.与SCR法相比,等物质的量的尿素与氨气可消除的NO物质的量之比为___.(不考虑副反应)
▼优质解答
答案和解析
(1)①NO+O3⇌NO2+O2 反应①的平衡常数为K1=
,②NO2+O⇌NO+O2 反应②的平衡常数为K2=
,反应O3+O⇌2O2的平衡常数K=
,据此分析计算得到K=K1•K2,一氧化氮反应生成二氧化氮,二氧化氮反应又生成一氧化氮,说明氮氧化物在该反应中的作用是催化剂的作用,
故答案为:K1•K2;催化剂;
(2)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0,提高NO平衡转化率改变条件使平衡正向进行;
反应为气体体积增大的放热反应,可以降低温度、减小压强使平衡正向进行,减少副反应应使副反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)平衡逆向进行,结合化学平衡移动原理分析,需要选择合适的催化剂、控制氧气用量促进4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0反应进行,避免副反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)进行,
故答案为:降低温度、减小压强;选择合适的催化剂、控制氧气用量;
(3)①图象中曲线变化可知低温下乙的催化作用强,工业上选择催化剂乙的原因是低温下有很强的催化活性,
故答案为:低温下有很强的催化活性;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小,在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率,高于210℃时,NO转化率降低是催化剂活性降低,副反应增多,
故答案为:一定不是;催化剂活性降低、副反应增多;
(4)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0
尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分,反应的化学方程式为2(NH2)2CO+6NO=5N2+2CO2+4H2O,等物质的量的尿素与氨气可消除的NO物质的量之比=12:4=3:1,
故答案为:3:1.
| c(NO2)c(O2) |
| c(NO)c(O3) |
| c(O2)c(NO) |
| c(NO2)c(O) |
| c2(O2) |
| c(O3)c(O) |
故答案为:K1•K2;催化剂;
(2)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0,提高NO平衡转化率改变条件使平衡正向进行;
反应为气体体积增大的放热反应,可以降低温度、减小压强使平衡正向进行,减少副反应应使副反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)平衡逆向进行,结合化学平衡移动原理分析,需要选择合适的催化剂、控制氧气用量促进4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0反应进行,避免副反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)进行,
故答案为:降低温度、减小压强;选择合适的催化剂、控制氧气用量;
(3)①图象中曲线变化可知低温下乙的催化作用强,工业上选择催化剂乙的原因是低温下有很强的催化活性,
故答案为:低温下有很强的催化活性;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小,在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率,高于210℃时,NO转化率降低是催化剂活性降低,副反应增多,
故答案为:一定不是;催化剂活性降低、副反应增多;
(4)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)△H<0
尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分,反应的化学方程式为2(NH2)2CO+6NO=5N2+2CO2+4H2O,等物质的量的尿素与氨气可消除的NO物质的量之比=12:4=3:1,
故答案为:3:1.
看了 氮氧化物排放是形成臭氧层空洞...的网友还看了以下:
加热会使蛋白质变性,在变性过程中肽键是否因此而断裂呢?请设计一个证明“蛋白质在加热变性后肽键没有断 2020-05-14 …
设f(x)=[g(x)-e^(-x)]/x(x不等于0)0(x=0),其中g(x)是有二阶连续函数 2020-05-17 …
f(g(x))是什么意思?如果h(x)=4x?-16,f(g(x))=h(x),找函数f和g.f( 2020-06-08 …
设f(x),g(x)在[0,1],上的导数连续,且f(0)=0,f'(x),g'(x)>=0.证明 2020-06-11 …
如图所示,用50N的力拉一个质量为10kg的物体在水平地面上前进.(1)若物体前进了10m,拉力F 2020-06-12 …
证明,高数,导数设f(x),g(x)都为可导函数,且f'(x)=g(x),g'(x)=-f(x), 2020-07-16 …
凸函数f(x)连续,g(x)[0,1]上可积分,复合函数f(g(x))[0,1]上可积分,证明:f 2020-08-02 …
用50N的力拉一个质量为10kg的物体在水平地面上前进,拉力与水平方向的夹角为37°.若物体前进了1 2020-10-31 …
高三物理题!质量为0.1的物体自离地面80米高处做自由落体运动,物体在下落第3妙内重力所做的平均功率 2020-11-24 …
绷紧水平的传送皮带以稳定的速率v=3m/s运行,今在起点处轻轻地放上一个质量m=0.5kg的物体,皮 2020-12-28 …