早教吧作业答案频道 -->化学-->
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0),(1)该反应450℃的平衡常数500℃时的平衡常数(填“>”、
题目详情
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0),
(1)该反应450℃的平衡常数___500℃时的平衡常数(填“>”、“<”或“=”).该反应达到平衡时混合气体的平均式量的范围是___
(2)下列描述中能说明上述反应已达平衡的是___
A、3V正(H2)=2V逆(NH3) B、容器中气体的平均分子量不随时间而变化
C、容器中气体的密度不随时间而变化 D、容器中气体的分子总数不随时间而变化
如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为___mol/(L.min).
(3)下列研究目的和示意图相符的是___.
(4)若第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___ (填序号);
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡___移动(填“向正反应方向”“向逆反应方向”或“不”).
N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0),
(1)该反应450℃的平衡常数___500℃时的平衡常数(填“>”、“<”或“=”).该反应达到平衡时混合气体的平均式量的范围是___
(2)下列描述中能说明上述反应已达平衡的是___
A、3V正(H2)=2V逆(NH3) B、容器中气体的平均分子量不随时间而变化
C、容器中气体的密度不随时间而变化 D、容器中气体的分子总数不随时间而变化
如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为___mol/(L.min).
(3)下列研究目的和示意图相符的是___.
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 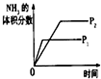 | 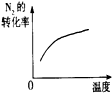 | 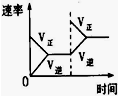 | 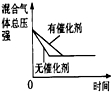 |
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡___移动(填“向正反应方向”“向逆反应方向”或“不”).
▼优质解答
答案和解析
(1)该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,所以该反应450℃的平衡常数>500℃时的平衡常数;如果没有反应其平均摩尔质量=
=8.5g/mol,如果完全反应其摩尔质量为氨气摩尔质量是17g/mol,实际上混合气体摩尔质量在二者之间,即大于8.5g/mol、小于17g/mol,摩尔质量在数值上等于其相对分子质量,所以其平均式量范围为8.5<平均式量<17,
故答案为:>;8.5<平均式量<17;
(2)A、2V正(H2)=3V逆(NH3)时反应达到平衡状态,所以当3V正(H2)=2V逆(NH3)时没有达到平衡状态,故错误;
B、反应前后混合气体总质量不变、物质的量减小,则反应前后混合气体平局分子量增大,当容器中气体的平均分子量不随时间而变化时正逆反应速率相等,反应达到平衡状态,故正确;
C、无论反应是否达到平衡状态,容器中气体的密度不随时间变化,所以不能据此判断平衡状态,故错误;
D、反应前后气体物质的量减小,分子数减小,当容器中气体的分子总数不随时间而变化时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
生成0.2mol氨气消耗0.1mol氮气,平均反应速率v(N2)=
=
=0.02mol/(L.min),
故答案为:BD;0.02;
(3)A.增大压强,化学反应速率增大,反应到达平衡的时间缩短,平衡正向移动,氨气的体积分数增大所以图象不符合,故A错误;
B.升高温度,平衡逆向移动,氮气的转化率降低,所以图象不符合,故B错误;
C.增大反应物浓度瞬间正反应速率增大、逆反应速率不变,平衡正向移动,图象符合,故C正确;
D.催化剂改变化学反应速率,但不影响平衡移动,图象不符合,故D错误;
故选C;
(4)如果升高温度平衡逆向移动,氨气浓度大于0而小于0.10mol/L;
如果降低温度平衡正向移动,则氨气浓度大于0.10mol/L而小于0.20mol/L,
所以其浓度不可能是AC;
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,相当于增大压强,增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,
故答案为:AC;向正反应方向.
| 0.2mol×28g/mol+0.6mol×2g/mol |
| 0.6mol+0.2mol |
故答案为:>;8.5<平均式量<17;
(2)A、2V正(H2)=3V逆(NH3)时反应达到平衡状态,所以当3V正(H2)=2V逆(NH3)时没有达到平衡状态,故错误;
B、反应前后混合气体总质量不变、物质的量减小,则反应前后混合气体平局分子量增大,当容器中气体的平均分子量不随时间而变化时正逆反应速率相等,反应达到平衡状态,故正确;
C、无论反应是否达到平衡状态,容器中气体的密度不随时间变化,所以不能据此判断平衡状态,故错误;
D、反应前后气体物质的量减小,分子数减小,当容器中气体的分子总数不随时间而变化时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
生成0.2mol氨气消耗0.1mol氮气,平均反应速率v(N2)=
| ||
| △t |
| ||
| 5min |
故答案为:BD;0.02;
(3)A.增大压强,化学反应速率增大,反应到达平衡的时间缩短,平衡正向移动,氨气的体积分数增大所以图象不符合,故A错误;
B.升高温度,平衡逆向移动,氮气的转化率降低,所以图象不符合,故B错误;
C.增大反应物浓度瞬间正反应速率增大、逆反应速率不变,平衡正向移动,图象符合,故C正确;
D.催化剂改变化学反应速率,但不影响平衡移动,图象不符合,故D错误;
故选C;
(4)如果升高温度平衡逆向移动,氨气浓度大于0而小于0.10mol/L;
如果降低温度平衡正向移动,则氨气浓度大于0.10mol/L而小于0.20mol/L,
所以其浓度不可能是AC;
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,相当于增大压强,增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,
故答案为:AC;向正反应方向.
看了 在一固定容积为2L的密闭容器...的网友还看了以下:
对于定义域为D的函数y=f(x),如果存在区间[m,n]⊆D(m<n),同时满足:①f(x)在[m 2020-04-12 …
在任意两个正整数m,n之间定义一种运算关系“*”:(m+1)*n=m*n+2,m*(n+1)=m* 2020-05-14 …
定义映射f:A→B,其中A={(m,n)|m,n∈R}接着 B=R,已知对所有的有序正整数对(m, 2020-05-16 …
设a>1,函数y=|logax|的定义域为【m,n】(m<n),值域为【0,1】,定义“区间[m, 2020-05-16 …
对于集合M与N定义M-N={x丨x属于M且x不属于N},则M-(M-N)= 2020-05-21 …
对任意两个正整数m,n,定义某种运算(用○×表示运算符号):当m,n都是正偶数或都是正奇数时,m○ 2020-07-30 …
高一数学设A={x/x2+4x=0},B={x/x2+2(a+1)x+a2-1=0(1)若A交B, 2020-08-02 …
设M,N为两个随机事件,如果M,N为互斥事件(.M,.N表示M,N的对立事件),那么()A..M∪. 2020-12-01 …
定义映射f:A→B,其中A={(m,n)|m,n∈R},B=R,已知对所有的有序正整数对(m,n)满 2020-12-05 …
任意一个两位数M的两个数字对调一下,得到一个新的两位数N.问M与N的和(M+N)一定是11的倍数吗? 2021-02-02 …