早教吧作业答案频道 -->化学-->
为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:第I组第Ⅱ组第Ⅲ组稀
题目详情
为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
根据实验及有关数据进行分析与计算:
(1)第I组实验中反应物___(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完.
(2)20g样品中含氧化铜的质量为___g.
(3)根捃第Ⅰ组数据计算所用的稀硫酸溶质的质量分数(写出计算过程)
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图.
| 第I组 | 第Ⅱ组 | 第Ⅲ组 | |
| 稀硫酸的质量/g | 50 | 100 | 150 |
| 溶解固体的质量/g | 10.0 | 16.0 | 16.0 |

(1)第I组实验中反应物___(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完.
(2)20g样品中含氧化铜的质量为___g.
(3)根捃第Ⅰ组数据计算所用的稀硫酸溶质的质量分数(写出计算过程)
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图.
▼优质解答
答案和解析
(1)样品中的氧化铜和硫酸反应而铜不和硫酸反应,第I组实验中反应物是氧化铜与稀硫酸;故填:氧化铜与稀硫酸;
(2)20g样品中含氧化铜的质量16g,故填:16.
样品中氧化铜的质量分数:
×100%=80%,故填80%.
(3)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
80 98
10g 50g•x
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(4)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO+H2SO4═CuSO4+H2O
80 98 160
16g 24.5%y z
=
=
解得 y=80g
解得 z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4+2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
=
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98
32g 10%n w
=
=
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如图.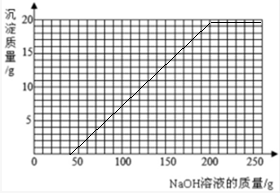
(2)20g样品中含氧化铜的质量16g,故填:16.
样品中氧化铜的质量分数:
| 16g |
| 20g |
(3)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
80 98
10g 50g•x
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(4)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO+H2SO4═CuSO4+H2O
80 98 160
16g 24.5%y z
| 80 |
| 16g |
| 98 |
| 24.5%y |
| 160 |
| z |
解得 y=80g
解得 z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4+2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
| 98 |
| (100g-80g)×24.5% |
| 80 |
| 10%m |
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98
32g 10%n w
| 160 |
| 32g |
| 80 |
| 10%n |
| 98 |
| w |
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如图.

看了 为分析某由氧化铜和铜组成的混...的网友还看了以下:
怎样把浓盐酸(12mol/l)稀释成ph=5的稀盐酸?实验室只有原装浓盐酸,实验要求用Ph=5的稀 2020-05-13 …
配制 100ml 0.5mol·L -1 盐酸 实验用品 100ml容量瓶、烧杯、10ml 量筒、 2020-05-16 …
某课外活动小组用铜屑制取五水合硫酸铜晶体.已知硫酸铜和硝酸铜的溶解度数据如下表:T/℃020406 2020-05-17 …
高二化学:已知某酸H2A是强酸,实验表明0.1mol/L的H2A溶液中c(H+)=0.11ml/L 2020-05-24 …
今天第一次接触到浓盐酸实体,老是冒烟.吓到了,请问下36.46.浓酸如何配成0.5%稀酸液?希望大 2020-06-23 …
若集合A={a|x^2-2x+a=0有实数根,B={ax^2-x+1=0}没有实数根,求A∩B若集 2020-08-01 …
如何用浓盐酸配制100mL浓度为0.31mol/L的稀盐酸实验室今有一瓶缺标签的浓盐酸(已开封),可 2020-11-12 …
怎样计算原油中的硫的质量分数和酸值?原油分为高硫低酸值原油(S≥1.0%Wt,酸值≤0.5mgKOH 2020-12-02 …
函数f(x)=根号下(mx^2+mx+1)的定义域为一切实数,则实数m的取值范围是()A.(0,4) 2020-12-08 …
(2013•房山区一模)对于实数x,将满足“0≤y<1且x-y为整数”的实数y称为实数x的小数部分, 2020-12-10 …