早教吧作业答案频道 -->化学-->
合成氨原料气H2可通过CO和水蒸气在一定条件下反应制得.(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为.(2)
题目详情
合成氨原料气H2可通过CO和水蒸气在一定条件下反应制得.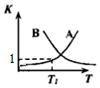
(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为___.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为___(选填“A”或“B”),理由是___.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是___(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是___(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[
],平衡时混合气体中CO的体积分数如表所示:
①T2、T3、T4的大小关系为___,判断的理由是___.
②维持温度不变,若要使CO的转化率升高,可以改变的条件是___.
③温度为T3℃、
=1时,变换后的平衡混合气体中H2的体积分数是___.

(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为___.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为___(选填“A”或“B”),理由是___.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是___(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是___(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[
| n(H20) |
| n(C0) |
| CO体积分数% 投料比 | 温度/℃ | ||||||
| 200 | T2 | T3 | T4 | ||||
| 1 | 1.70 | 2.73 | 6.00 | 7.85 | ||
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |||
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |||
②维持温度不变,若要使CO的转化率升高,可以改变的条件是___.
③温度为T3℃、
| n(H20) |
| n(C0) |
▼优质解答
答案和解析
(1)根据CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;可得①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1,
②H2(g)+
O2(g)=H2O(l)△H=-285.8•mol -1,
③H2O(l)═H2O(g)△H=+44kJ•mol-1,
根据盖斯定律①-②-③可得CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
故答案为:CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
(2)正反应为放热反应,升高温度,平衡向逆向移动,K值减小,曲线为B;
故答案为:B;正反应为放热反应,升高温度,平衡向逆向移动,K值减小;
(3)容积固定为5L的容器,设平衡时水蒸气的转化率为a,列三段式:
CO(g)+H2O(g)=CO2 (g)+H2 (g)
起始(mol/L):0.6 0.4 0 0
转化(mol/L):0.4a 0.4a 0.4a 0.4a
平衡(mol/L):0.6-0.4a 0.4-0.4a 0.4a 0.4a
根据图可知T1℃时,K=
=1,解得,a=0.6=60%;
故答案为:60%;
(4)反应 CO(g)+H2O(g)=CO2 (g)+H2 (g):
a.该反应是气体体积不变,任何时刻容器内压强都一样,故a错误;
b.混合气体总质量不变,恒容容器体积不变,根据ρ=
混合气体的密度不改变,故b错误;
c.单位时间内生成a mol CO2说明生成了a mol的H2,同时消耗a molH2,说明正逆反应速率相等,故c正确;
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6,设容器体积为V,则此时Qc=
=1=K,反应在平衡状态,故d正确;
故答案为:c d;
(5)①该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
故答案为;T2<T3<T4;该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
②维持温度不变,要使CO的转化率升高,可用加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
故答案为:加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
③反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中,反应恰好气体的体积不变,则反应过程中气体的总体积不变,设反应前气体总体积为V,则CO的体积为30%VL=0.3VL,二氧化碳的体积为:10V%=0.1V,
由于
=1,则加入的水蒸气的体积为30%V,反应达到平衡时气体总体积为:V+0.3V=1.3V,
温度为300℃达到平衡时CO的体积分数为6%,则反应消耗的CO=生成的H2的体积=0.3V-1.3V×6%=0.222V,达到平衡时H2的体积分数为
×100%=47.8%;
故答案为:47.8%.
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③H2O(l)═H2O(g)△H=+44kJ•mol-1,
根据盖斯定律①-②-③可得CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
故答案为:CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
(2)正反应为放热反应,升高温度,平衡向逆向移动,K值减小,曲线为B;
故答案为:B;正反应为放热反应,升高温度,平衡向逆向移动,K值减小;
(3)容积固定为5L的容器,设平衡时水蒸气的转化率为a,列三段式:
CO(g)+H2O(g)=CO2 (g)+H2 (g)
起始(mol/L):0.6 0.4 0 0
转化(mol/L):0.4a 0.4a 0.4a 0.4a
平衡(mol/L):0.6-0.4a 0.4-0.4a 0.4a 0.4a
根据图可知T1℃时,K=
| 0.4a×0.4a |
| (0.6-0.4a)×(0.4-0.4a) |
故答案为:60%;
(4)反应 CO(g)+H2O(g)=CO2 (g)+H2 (g):
a.该反应是气体体积不变,任何时刻容器内压强都一样,故a错误;
b.混合气体总质量不变,恒容容器体积不变,根据ρ=
| m |
| V |
c.单位时间内生成a mol CO2说明生成了a mol的H2,同时消耗a molH2,说明正逆反应速率相等,故c正确;
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6,设容器体积为V,则此时Qc=
| (6÷V)×(6÷V) |
| (9÷V)×(4÷V) |
故答案为:c d;
(5)①该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
故答案为;T2<T3<T4;该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
②维持温度不变,要使CO的转化率升高,可用加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
故答案为:加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
③反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中,反应恰好气体的体积不变,则反应过程中气体的总体积不变,设反应前气体总体积为V,则CO的体积为30%VL=0.3VL,二氧化碳的体积为:10V%=0.1V,
由于
| n(H2O) |
| n(CO) |
温度为300℃达到平衡时CO的体积分数为6%,则反应消耗的CO=生成的H2的体积=0.3V-1.3V×6%=0.222V,达到平衡时H2的体积分数为
| 0.222V+0.4V |
| 1.3V |
故答案为:47.8%.
看了 合成氨原料气H2可通过CO和...的网友还看了以下:
分式求和问题1/(2^k+1)+1/(2^k+2)+…+1/2^(k+1)为什么1/(2^k+1) 2020-04-26 …
设A为n阶矩阵,正整数k>=2,那么:(1)若A为对称矩阵,问A∧k是否为对称矩阵?为什么?(2) 2020-05-14 …
如果半波损在薄膜上表面,则光程差为2ne-λ/2,这种情况k=1,2,3如果半波损在薄膜下表面,则 2020-06-12 …
已知关于x的方程x^2-(2k+1)x+4(k-1/2)=0.(1)求证,无论k取何值,这个方程总 2020-06-12 …
下列关于热化学反应的描述中正确的是()A.CO燃烧是吸热反应B.需要加热才能发生的反应一定是吸热反 2020-07-19 …
下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则 2020-07-19 …
如图,过点C(1,2)分别作x轴、y轴的平行线,交直线y=-x+6于A、B两点,若反比例函数y=k 2020-07-20 …
已知,正比例函数y=ax图像上的点的横坐标与纵坐标互为相反数.反比例函数y=k/x,y随x增大而减 2020-08-03 …
(y)减一污染、保护环境是全世界最热门的课题.Cw在催化剂作用下可以与小k反应生成甲醇:Cw(g)+ 2020-11-01 …
勾股数的通式证明我发现了一个貌似的勾股数的通式它是k*(n)和k*((n^2)-1)/2和k*((n 2020-11-06 …