早教吧作业答案频道 -->化学-->
研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1③
题目详情
研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O (g)△H3=-483.6kJ•mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为___.
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
①实验2和实验3相比,其平衡常数关系是K2___K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为___.
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
2“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为___.
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为___.
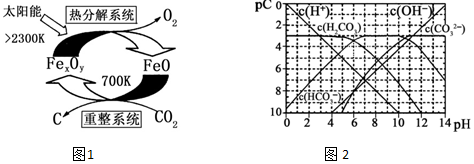
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×10-3)=3.如图2为25℃时H2CO3溶液的pC-pH图.请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-___(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1=___.
③人体血液里主要通过碳酸氢盐缓冲体系
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
最终将___.
A.变大B.变小C.基本不变D.无法判断.
(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O (g)△H3=-483.6kJ•mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为___.
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为___.
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
2“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为___.
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为___.

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×10-3)=3.如图2为25℃时H2CO3溶液的pC-pH图.请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-___(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1=___.
③人体血液里主要通过碳酸氢盐缓冲体系
| c(H2CO3) | ||
c(HC
|
| c(H+) |
| c(H2CO3) |
A.变大B.变小C.基本不变D.无法判断.
▼优质解答
答案和解析
(1)有热化学方程式:
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O (g)△H3=-483.6kJ•mol-1
根据盖斯定律:①+②+
×③得CH4(g)+
O2 (g)⇌CH3OH(l)△H1=-164.0kJ•mol-1.
故答案为:CH4(g)+
O2 (g)⇌CH3OH(l)△H1=-164.0kJ•mol-1
(2)①反应一是吸热反应,温度升高,化学平衡正向移动,k值变大,实验2的温度高于实验3,所以k2>k3
故答案为:>
②设CH4和H2O的起始量为x,根据三段式:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量:x x 0 0
转化量:0.1 0.1 0.1 0.3
平衡量:x-0.1 x-0.1 0.1 0.3
由平衡常数表达式k=
=
=27,解得x=0.11,则平衡时甲烷的转化率为:
×100%=90.9%.
故答案为:
(90.9%、90.91%、
×100%)
(3))①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=6:1,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4.
故答案为:Fe 3O4
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为1mol×3×(
-2)=2mol.
故答案为:2mol
(4)①碳酸存在的溶液中酸性较强、碳酸根离子存在的溶液中碱性较强,所以碳酸根离子和碳酸不能大量共存.
故答案为:不能;
②由图象可知当pH=6时,pC(H2CO3)=pC(HCO3-),结合Ka1(H2CO3)=
=
=1×10-6.
故答案为:1×10-6
③氢离子浓度增大,平衡向左移动放出CO2,碳酸浓度基本不变,则c(H+)/c(H2CO3)最终将变大.
故答案为:A
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O (g)△H3=-483.6kJ•mol-1
根据盖斯定律:①+②+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CH4(g)+
| 1 |
| 2 |
(2)①反应一是吸热反应,温度升高,化学平衡正向移动,k值变大,实验2的温度高于实验3,所以k2>k3
故答案为:>
②设CH4和H2O的起始量为x,根据三段式:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量:x x 0 0
转化量:0.1 0.1 0.1 0.3
平衡量:x-0.1 x-0.1 0.1 0.3
由平衡常数表达式k=
| c(CO)•c3(△H2) |
| c(CH4)•c(H2O) |
| 0.1mol/L•(0.3mol/L)3 |
| (x-0.1)mol/L•(x-0.1)mol/L |
| 0.1mol |
| 0.11mol |
故答案为:
| 10 |
| 11 |
| 10 |
| 11 |
(3))①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=6:1,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4.
故答案为:Fe 3O4
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为1mol×3×(
| 8 |
| 3 |
故答案为:2mol
(4)①碳酸存在的溶液中酸性较强、碳酸根离子存在的溶液中碱性较强,所以碳酸根离子和碳酸不能大量共存.
故答案为:不能;
②由图象可知当pH=6时,pC(H2CO3)=pC(HCO3-),结合Ka1(H2CO3)=
| c(H+)•c(HCO3-) |
| c(H2CO3) |
| 10-6•c(HCO3-) |
| c(H2CO3) |
故答案为:1×10-6
③氢离子浓度增大,平衡向左移动放出CO2,碳酸浓度基本不变,则c(H+)/c(H2CO3)最终将变大.
故答案为:A
看了 研究碳及其化合物的相互转化对...的网友还看了以下:
设m、n是两条不同的直线,α,β是两个不同的平面,则m⊥α的一个充分条件是()A.m∥n,n∥β, 2020-07-13 …
如图所示,一个质量为m,顶角为α的直角劈和一个质量为M的长方形木块,夹在两竖直墙之间,不计摩擦,则 2020-07-14 …
已知l,m,n是三条不同的直线,α,β是不同的平面,则α⊥β的一个充分条件是()A.lα,mβ,且 2020-07-26 …
镍氢电池的化学方程式为NiO(OH)+MH放电充电Nio+M+H2O(M为储氢合金,电解质为KOH 2020-07-29 …
已知映射f:M→N,使集合N中的元素y=x2与集合M中的元素x对应,要使映射f:M→N是一一对应, 2020-07-30 …
“不等式x2-x+m>0在R上恒成立”的一个必要不充分条件是()A.m>B.0<m<1C.m>0D 2020-08-03 …
“不等式x2-x+m>0在R上恒成立”的一个必要不充分条件是()A.m>14B.0<m<1C.m> 2020-08-03 …
补充对话M:hello!J:hello,Marry!thisisjack.M:oh,jack!1J: 2020-10-30 …
已知直线m,n和平面a,则m∥n的一个必要非充分条件是()A.m∥a且n∥aB.m⊥a且n⊥aC.m 2020-11-02 …
若直角坐标平面内的两个不同点M、N满足条件:①M、N都在函数y=f(x)的图象上;②M、N关于原点对 2021-01-01 …