早教吧作业答案频道 -->化学-->
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.已知:①FeCO3+H2SO4═FeSO4+CO2↑+H2O②
题目详情
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.
已知:①FeCO3+H2SO4═FeSO4+CO2↑+H2O
②菱铁矿中杂质不参加反应,且难溶于水.
请计算:
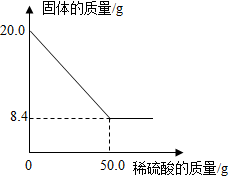
(1)20.0g菱铁矿中FeCO3的质量为___g.
(2)该反应中生成CO2的质量为___g.
(3)列式计算所用稀硫酸的溶质质量分数(结果准确到0.1%)
已知:①FeCO3+H2SO4═FeSO4+CO2↑+H2O
②菱铁矿中杂质不参加反应,且难溶于水.
请计算:

(1)20.0g菱铁矿中FeCO3的质量为___g.
(2)该反应中生成CO2的质量为___g.
(3)列式计算所用稀硫酸的溶质质量分数(结果准确到0.1%)
▼优质解答
答案和解析
(1)20.0g菱铁矿中FeCO3的质量为:20.0g-8.4g=11.6g,
(2)设反应中生成CO2的质量为x,硫酸的质量为y,
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 98 44
11.6g y x
=
=
x=4.4g
y=9.8g
所用稀硫酸的溶质质量分数为:
×100%=19.6%
答案:
(1)11.6;
(2)4.4;
(3)所用稀硫酸的溶质质量分数为19.6%.
(1)20.0g菱铁矿中FeCO3的质量为:20.0g-8.4g=11.6g,
(2)设反应中生成CO2的质量为x,硫酸的质量为y,
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 98 44
11.6g y x
| 116 |
| 11.6g |
| 98 |
| y |
| 44 |
| x |
x=4.4g
y=9.8g
所用稀硫酸的溶质质量分数为:
| 9.8g |
| 50g |
答案:
(1)11.6;
(2)4.4;
(3)所用稀硫酸的溶质质量分数为19.6%.
看了 菱铁矿(主要成分是FeCO3...的网友还看了以下:
如图,在菱形ABCD中,∠A=60°,AB=4,O是对角线BD的中点,过O点作OE丄AB,垂足为E 2020-05-13 …
(2014•苏州)如图,直线l与半径为4的⊙O相切于点A,P是⊙O上的一个动点(不与点A重合),过 2020-06-12 …
已知点P的坐标是(-3,4)O是坐标原点,直线L垂直OP,O是垂足,求直线L表示的函数 2020-07-21 …
不改变O的总个数,要使第一行比第二行少4个O,应怎么摆?第一行;OOOOO,第二行;O不改变O的总 2020-07-22 …
(2012•道里区二模)如图,在平面直角坐标系内,点O为坐标原点,直线y=12x+3交x轴于点A, 2020-07-30 …
某花铺摆放的一组花盆图案(O代表玫瑰花盆,△代表菊花花盆)(1)△:4个O:1个(2)△:8个O: 2020-08-01 …
在Rt△ABC中,∠A=90°,AB=3,AC=4,O是边BC的中点,过点D的直线,将△ABC分割 2020-08-03 …
如图,在菱形ABCD中,∠A=60°,AB=4,O是对角线BD的中点,过O点作OE丄AB,垂足为E. 2020-11-03 …
如果对于任意非零有理数ab定义运算◎如下:aOb=ab+1,那么(-5)O(+4)O(-3)的值是多 2020-11-14 …
最能告诉我这段函数计算能否用更简单的公式代替?=COUNTIFS('4月'!$B$1:$B$1500 2020-11-20 …