早教吧作业答案频道 -->化学-->
利用如图装置测定中和热的实验步骤如下:①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;②量取50mL0.55mol/LNaOH溶液,测量温度;③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温
题目详情
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
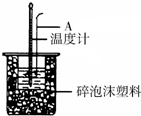
(1)如图所示,仪器A的名称是___;
(2)NaOH溶液稍过量的原因___.
(3)加入NaOH溶液的正确操作是___(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是___.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式___
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?___.利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:

(1)如图所示,仪器A的名称是___;
(2)NaOH溶液稍过量的原因___.
(3)加入NaOH溶液的正确操作是___(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是___.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式___
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?___.
24

-3-1
温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2-t1)/℃ H2SO4 NaOH 平均值 1 25.0 25.2 28.5 2 24.9 25.1 28.3 3 25.5 26.5 31.8 4 25.6 25.4 29.0 温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2-t1)/℃ 温度
实验次数
起始温度t1/℃ 1终止温度
t2/℃
2温度差平均值
(t2-t1)/℃
21 H2SO4 NaOH 平均值 H2SO4 24NaOH 平均值 1 25.0 25.2 28.5 1 25.0 25.2 28.5 2 24.9 25.1 28.3 2 24.9 25.1 28.3 3 25.5 26.5 31.8 3 25.5 26.5 31.8 4 25.6 25.4 29.0 4 25.6 25.4 29.0
24
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:

(1)如图所示,仪器A的名称是___;
(2)NaOH溶液稍过量的原因___.
(3)加入NaOH溶液的正确操作是___(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是___.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式___
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?___.利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:

(1)如图所示,仪器A的名称是___;
(2)NaOH溶液稍过量的原因___.
(3)加入NaOH溶液的正确操作是___(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是___.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式___
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?___.
24

-3-1
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
实验次数
t2/℃
(t2-t1)/℃
实验次数
t2/℃
(t2-t1)/℃
实验次数
t2/℃
2
(t2-t1)/℃
21
24
▼优质解答
答案和解析
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)实验中,所用NaOH稍过量的原因是确保定量的硫酸反应完全,
故答案为:确保硫酸被完全中和;
(3)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:B;
(4)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,
故答案为:用环形玻璃棒轻轻搅动;
(5)第1次实验H22SO44和NaOH溶液起始平均温度为25.1℃,反应后温度为28.5℃,反应前后温度差为3.4℃;
第2次实验H22SO44和NaOH溶液起始平均温度为25.0℃,反应后温度为28.3℃,反应前后温度差为3.3℃;
第3次实验H22SO44和NaOH溶液起始平均温度为26.0℃,反应后温度为31.8℃,反应前后温度差为5.8℃;
第4次实验H22SO44和NaOH溶液起始平均温度为25.5℃,反应后温度为29.0℃,反应前后温度差为3.5℃;
第3次实验误差较大,舍去,其他三次实验的平均值为
℃=3.4℃,Q=△H=-△Tcm=-3.4℃×4.18J/(g•℃)×100mL×1g/mL═1.4212kJ/mol,50moL 0.25mol•L-1硫酸与50mL 0.55mol/L NaOH溶液的中和反应生成水的物质的量是0.025mol,所以生成2mol水放出的热量为:
×2=113.7kJ•mol-1,所以热化学方程式为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1,
故答案为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
3.4+3.3+3.5 3 3.4+3.3+3.5 3.4+3.3+3.5 3.4+3.3+3.53 3 3℃=3.4℃,Q=△H=-△Tcm=-3.4℃×4.18J/(g•℃)×100mL×1g/mL═1.4212kJ/mol,50moL 0.25mol•L-1-1硫酸与50mL 0.55mol/L NaOH溶液的中和反应生成水的物质的量是0.025mol,所以生成2mol水放出的热量为:
×2=113.7kJ•mol-1,所以热化学方程式为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1,
故答案为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
1.4212kJ 0.025mol 1.4212kJ 1.4212kJ 1.4212kJ0.025mol 0.025mol 0.025mol×2=113.7kJ•mol-1-1,所以热化学方程式为:H22SO44(aq)+2NaOH(aq)Na22SO44(aq)+2H22O(l)△H=-113.7kJ•mol-1-1,
故答案为:H22SO44(aq)+2NaOH(aq)Na22SO44(aq)+2H22O(l)△H=-113.7kJ•mol-1-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H22SO44测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
故答案为:环形玻璃搅拌棒;
(2)实验中,所用NaOH稍过量的原因是确保定量的硫酸反应完全,
故答案为:确保硫酸被完全中和;
(3)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:B;
(4)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,
故答案为:用环形玻璃棒轻轻搅动;
(5)第1次实验H22SO44和NaOH溶液起始平均温度为25.1℃,反应后温度为28.5℃,反应前后温度差为3.4℃;
第2次实验H22SO44和NaOH溶液起始平均温度为25.0℃,反应后温度为28.3℃,反应前后温度差为3.3℃;
第3次实验H22SO44和NaOH溶液起始平均温度为26.0℃,反应后温度为31.8℃,反应前后温度差为5.8℃;
第4次实验H22SO44和NaOH溶液起始平均温度为25.5℃,反应后温度为29.0℃,反应前后温度差为3.5℃;
第3次实验误差较大,舍去,其他三次实验的平均值为
| 3.4+3.3+3.5 |
| 3 |
| 1.4212kJ |
| 0.025mol |
故答案为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
| 3.4+3.3+3.5 |
| 3 |
| 1.4212kJ |
| 0.025mol |
故答案为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
| 1.4212kJ |
| 0.025mol |
故答案为:H22SO44(aq)+2NaOH(aq)Na22SO44(aq)+2H22O(l)△H=-113.7kJ•mol-1-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H22SO44测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
看了 利用如图装置测定中和热的实验...的网友还看了以下:
假设在过点O(0,0)和A(π,0)的曲线族y=asinx(a>0)中,有一条曲线L,使沿该曲线从 2020-06-22 …
(o)0.o25×0.d2×5=(2)o.25×0.25÷oo6=(d)0.25×o.25÷o6如 2020-07-09 …
(2010•台州)在如图所示的电路中,电源电压为5伏,L1、L2发光时的电阻均为6欧,小柯应选择两 2020-07-19 …
过点O(0,0)和A(π,0)的曲线族y=asinx(a>0)中,求一条曲线L,使沿该曲线O从到A 2020-07-21 …
在“探究单摆摆长与周期关系”的实验中,某同学的主要操作步骤如下:A.取一根符合实验要求的摆线,下端 2020-07-31 …
△OAB三个顶点的坐标分别为O(0,0),A(4,6),B(3,0),以O为位似中心,将△OAB缩 2020-08-02 …
过点O(0,0)和A(π,0)的曲线族y=asinx(a>0)中,求一条曲线L,使沿该曲线O从到A的 2020-10-31 …
相对论的小题两个惯性系中的观察者O和O'以0.6c的相对速度互相靠近,如果O测得两者的初始距离是20 2020-11-01 …
△ABO的顶点坐标分别为A(-3,3),B(3,3),O(0,0),试将△AOB缩小为△A′B′O, 2020-11-03 …
(j010•南通模拟)作为对数运算法则:lg(o+b)=lgo+lgb(o>0,b>0)是不正确的. 2020-11-12 …