早教吧作业答案频道 -->化学-->
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1②CH4(g)+12O2(g)═CO(g)+2H2(g)△H2=-36kJ•m
题目详情
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+
O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为___,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:___.
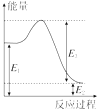
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=___时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是___.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
则△H1=___,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量___△H1.(用>,<或=填空)
2221-1
4
O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1

(1)氢气的燃烧热为___,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:___.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=___时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是___.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
则△H1=___,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量___△H1.(用>,<或=填空)
1 2 1 1 2 2 222-1
4223-1

2224
12
1231
23231
化学键 C-C C-H H-H C-O C≡O H-O 键能
(kJ•mol-1) 348 413 436 358 1072 463 化学键 C-C C-H H-H C-O C≡O H-O 化学键 C-C C-H H-H C-O C≡O H-O 键能
(kJ•mol-1) 348 413 436 358 1072 463 键能
(kJ•mol-1)
-1348 413 436 358 1072 463 121
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+
| 1 |
| 2 |
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1

(1)氢气的燃烧热为___,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:___.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=___时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是___.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
2221-1
4
| 1 |
| 2 |
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1

(1)氢气的燃烧热为___,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:___.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=___时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是___.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
| 1 |
| 2 |
4223-1

2224
12
1231
23231
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
(kJ•mol-1)
(kJ•mol-1)
(kJ•mol-1)
-1
▼优质解答
答案和解析
(1)2H22(g)+O22(g)═2H22O(l)△H11=-571.6kJ•mol-1-1,即1mol氢气完全燃烧生成液态水放出的热量285.8 kJ,故氢气的燃烧热为△H=-285.8 kJ•mol-1-1;
①2H22(g)+O22(g)═2H22O(l)△H11=-571.6kJ•mol-1-1
②CH44(g)+
O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH4(g)+
O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
故答案为:△H=-285.8 kJ•mol-1;CH4(g)+
O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差;
答案为:0.75;C;
(3)CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1;<.
1 2 1 1 12 2 2O22(g)═CO(g)+2H22(g)△H22=-36kJ•mol-1-1
依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH44(g)+
O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
故答案为:△H=-285.8 kJ•mol-1;CH4(g)+
O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差;
答案为:0.75;C;
(3)CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1;<.
3 2 3 3 32 2 2O22(g)═CO(g)+2H22O(l)△H=-607.6 kJ•mol-1-1;
故答案为:△H=-285.8 kJ•mol-1-1;CH44(g)+
O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差;
答案为:0.75;C;
(3)CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1;<.
3 2 3 3 32 2 2O22(g)═CO(g)+2H22O(l)△H=-607.6 kJ•mol-1-1;
(2)由反应②和③△H的数值可知,当O22与H22O的物质的量之比为3:1时,反应②与③的总能量变化为0,O22的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E11、E22数值的差;
答案为:0.75;C;
(3)CH33OH:CO(g)+2H22(g)═CH33OH(g)中的焓变△H11=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H11═1072kJ•mol-1-1+2×436kJ•mol-1-1-(3×413kJ•mol-1-1+358kJ•mol-1-1+463kJ•mol-1-1)=-116 kJ•mol-1-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH33OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1-1;<.
①2H22(g)+O22(g)═2H22O(l)△H11=-571.6kJ•mol-1-1
②CH44(g)+
| 1 |
| 2 |
依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH4(g)+
| 3 |
| 2 |
故答案为:△H=-285.8 kJ•mol-1;CH4(g)+
| 3 |
| 2 |
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差;
答案为:0.75;C;
(3)CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1;<.
| 1 |
| 2 |
依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH44(g)+
| 3 |
| 2 |
故答案为:△H=-285.8 kJ•mol-1;CH4(g)+
| 3 |
| 2 |
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差;
答案为:0.75;C;
(3)CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1;<.
| 3 |
| 2 |
故答案为:△H=-285.8 kJ•mol-1-1;CH44(g)+
| 3 |
| 2 |
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差;
答案为:0.75;C;
(3)CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1═1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1;<.
| 3 |
| 2 |
(2)由反应②和③△H的数值可知,当O22与H22O的物质的量之比为3:1时,反应②与③的总能量变化为0,O22的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E11、E22数值的差;
答案为:0.75;C;
(3)CH33OH:CO(g)+2H22(g)═CH33OH(g)中的焓变△H11=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H11═1072kJ•mol-1-1+2×436kJ•mol-1-1-(3×413kJ•mol-1-1+358kJ•mol-1-1+463kJ•mol-1-1)=-116 kJ•mol-1-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH33OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJ•mol-1-1;<.
看了 甲烷、一氧化碳和氢气、甲醇等...的网友还看了以下:
对于任意实数x,符号[x]表示x的整数部分,即[x]是不超过x的最大整数,那么[log3^1]+[ 2020-05-16 …
一个六位数,十万位是1,如果把1移到个位上,新六位数是原六位的3倍,求原谅6位数是多少?一个六位数 2020-05-16 …
一种中药原料6月份的价格比1月份下跌了12%,12月份的价格又比6月份上涨了15%.这种中药原料1 2020-05-21 …
有理数乘法有个问题...有理数乘法)要写解:原式吗本人刚学不久如6*(-9)解:原式=-(6*9) 2020-06-03 …
某厂每天需要原料6吨,每吨原料的价格为1800元,原料的保管费为每吨每天3元(当日消耗原料当日仍需 2020-06-13 …
3.某工厂定期购买一种原料。已知该厂每天需用该原料6吨,每吨价格......3.某工厂定期购买一种 2020-06-19 …
TSH促甲状腺激素0.161参考值0.55—4.78FT3游离三碘甲状腺原氨6.19参考值TSH促 2020-06-20 …
说明下列各音程可能属于哪些大.小调中(包括和声大,小调)在哪些音级上#5-35-#4b7-23-b7 2020-10-31 …
已知A、B、C、a是6~68号元素634种,0.tmolA元素3离子5到6.02×602小个电子被还 2020-12-28 …
某同学把3克碳放在给定的氧气中充分燃烧,实验数据如下:第一次第二次第三次给定的O2质量6克8克13克 2021-01-13 …