早教吧作业答案频道 -->化学-->
某实验小组模拟工业上用SiHCl3与H2在1357K的条件下制备高纯硅,实验装置如下图所示(加热及夹持装置略去):已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34g•mL-1;易溶于有机溶剂;能
题目详情
某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):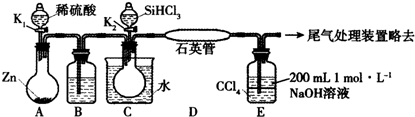
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g•mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化.请回答:
(1)装置C中的烧瓶用水浴加热的优点为___
(2)装置D中发生反应的化学方程式为___
(3)装置E的作用为___、___、___.
(4)相关实验步骤如下,其合理顺序为___(填序号).
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1;
④关闭K2;
⑤加热装置D至1357K.
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液.用0.1 mol•L-1盐 酸滴定,达到滴定终点时,消耗盐酸20.00 mL.达到滴定终点的现象是___.SiHCl3的利用率为___%(保留两位小数).
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___.某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g•mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化.请回答:
(1)装置C中的烧瓶用水浴加热的优点为___
(2)装置D中发生反应的化学方程式为___
(3)装置E的作用为___、___、___.
(4)相关实验步骤如下,其合理顺序为___(填序号).
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1;
④关闭K2;
⑤加热装置D至1357K.
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液.用0.1 mol•L-1盐 酸滴定,达到滴定终点时,消耗盐酸20.00 mL.达到滴定终点的现象是___.SiHCl3的利用率为___%(保留两位小数).
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___.32
3-12
23
1
1
2
3-13
3

已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g•mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化.请回答:
(1)装置C中的烧瓶用水浴加热的优点为___
(2)装置D中发生反应的化学方程式为___
(3)装置E的作用为___、___、___.
(4)相关实验步骤如下,其合理顺序为___(填序号).
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1;
④关闭K2;
⑤加热装置D至1357K.
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液.用0.1 mol•L-1盐 酸滴定,达到滴定终点时,消耗盐酸20.00 mL.达到滴定终点的现象是___.SiHCl3的利用率为___%(保留两位小数).
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___.某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):

已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g•mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化.请回答:
(1)装置C中的烧瓶用水浴加热的优点为___
(2)装置D中发生反应的化学方程式为___
(3)装置E的作用为___、___、___.
(4)相关实验步骤如下,其合理顺序为___(填序号).
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1;
④关闭K2;
⑤加热装置D至1357K.
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液.用0.1 mol•L-1盐 酸滴定,达到滴定终点时,消耗盐酸20.00 mL.达到滴定终点的现象是___.SiHCl3的利用率为___%(保留两位小数).
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___.32

3-12
23
1
1
2
3-13
3
▼优质解答
答案和解析
A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl33水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl33,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)水浴加热,受热均匀,得到平稳的SiHCl33气流,
故答案为:受热均匀,得到平稳的SiHCl33气流;
(2)D中氢气与SiHCl33反应生成Si与HCl,反应方程式为:SiHCl33+H22
Si+3HCl,
故答案为:SiHCl3+H2
Si+3HCl;
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×
=0.18mol,由SiHCl3+H2
Si+3HCl,可知参加反应SiHCl3为
=0.06mol,故SiHCl3的利用率为
×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
1357K 1357K 1357K 1357K Si+3HCl,
故答案为:SiHCl33+H22
Si+3HCl;
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×
=0.18mol,由SiHCl3+H2
Si+3HCl,可知参加反应SiHCl3为
=0.06mol,故SiHCl3的利用率为
×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
1357K 1357K 1357K 1357K Si+3HCl;
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl33,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl33;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×
=0.18mol,由SiHCl3+H2
Si+3HCl,可知参加反应SiHCl3为
=0.06mol,故SiHCl3的利用率为
×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
200mL 20mL 200mL 200mL 200mL20mL 20mL 20mL=0.18mol,由SiHCl33+H22
Si+3HCl,可知参加反应SiHCl3为
=0.06mol,故SiHCl3的利用率为
×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
1357K 1357K 1357K 1357K Si+3HCl,可知参加反应SiHCl33为
=0.06mol,故SiHCl3的利用率为
×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
0.18mol 3 0.18mol 0.18mol 0.18mol3 3 3=0.06mol,故SiHCl33的利用率为
×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
0.06mol×135.5g/mol 6.5mL×1.34g/mL 0.06mol×135.5g/mol 0.06mol×135.5g/mol 0.06mol×135.5g/mol6.5mL×1.34g/mL 6.5mL×1.34g/mL 6.5mL×1.34g/mL×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H++、Cl--可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
(1)水浴加热,受热均匀,得到平稳的SiHCl33气流,
故答案为:受热均匀,得到平稳的SiHCl33气流;
(2)D中氢气与SiHCl33反应生成Si与HCl,反应方程式为:SiHCl33+H22
| ||
故答案为:SiHCl3+H2
| ||
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×
| 200mL |
| 20mL |
| ||
| 0.18mol |
| 3 |
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
| ||
| 1357K |
. |
| 1357K |
. |
| 1357K |
. |
| 1357K |
. |
.
.
.
.
.故答案为:SiHCl33+H22
| ||
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×
| 200mL |
| 20mL |
| ||
| 0.18mol |
| 3 |
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
| ||
| 1357K |
. |
| 1357K |
. |
| 1357K |
. |
| 1357K |
. |
.
.
.
.
.(3)装置E的作用为:四氯化碳吸收未反应的SiHCl33,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl33;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×
| 200mL |
| 20mL |
| ||
| 0.18mol |
| 3 |
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
| 200mL |
| 20mL |
| ||
| 0.18mol |
| 3 |
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
| ||
| 1357K |
. |
| 1357K |
. |
| 1357K |
. |
| 1357K |
. |
.
.
.
.
.| 0.18mol |
| 3 |
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
| 0.18mol |
| 3 |
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
| 0.06mol×135.5g/mol |
| 6.5mL×1.34g/mL |
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H++、Cl--可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
看了 某实验小组模拟工业上用SiH...的网友还看了以下:
求通过点M(2,1,3)且与直线l:(x+1)/3=(y-1)/2=z/1垂直相交的直线L的方程( 2020-05-13 …
有关向量的一道题已知l的方向向量为a=(2,3),且过(1,2)点,求l的方程.a=(2,3)推出 2020-05-16 …
若广义表L=((1,2,3)),则L的长度和深度分别为______。A.3和2B.1和2C.1和3D 2020-05-26 …
若广义表L((1,2,3)),则L的长度和深度分别为(3)。A.1和1B.1和2C.1和3D.2和2 2020-05-26 …
近代化学基础急一1.在用量子数表示核外电子运动状态时,写出下列各组中所缺少的量子数.(1)n=3, 2020-06-04 …
python的问题L=[1,2,3,4]whileL:front,L=L[0],L[1:]prin 2020-06-12 …
(l-1/2-1/3-1/4-1/5)(1/2+1/3+1/4+1/5+1/6)一(l-1/2-/ 2020-06-29 …
数字3可以有四种方式表达为1个或几个正整数的有序和3,1+2,2+1,l+l+1,那么对于一般的正 2020-07-10 …
已知α1=(1,2,1,0),α2=(-1,1,1,1),β1=(2,-1,0,1),β2=(1, 2020-07-26 …
数字3可以有四种方式表达为1个或几个正整数的有序和3,1+2,2+1,l+l+1,那么对于一般的正整 2020-12-05 …