早教吧作业答案频道 -->化学-->
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:(1)将NaCl溶液进行电解,在电解槽的阴极发生的电极反应式.原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制
题目详情
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
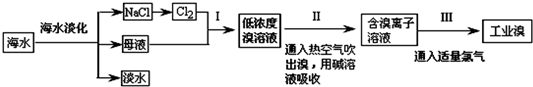
(1)将NaCl溶液进行电解,在电解槽的阴极发生的电极反应式___.原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是___(填序号)
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是:___.
某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如下实验装置:
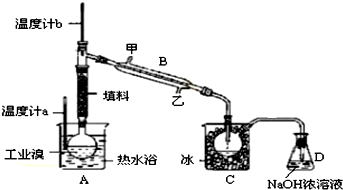
(3)图中冷却水的出口为___(填写“甲”或“乙”编号).
实验装置气密性良好,要达到提纯溴的目的,操作的关键是___.C中液体的颜色为___.
从海水中提取的食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如图所示:
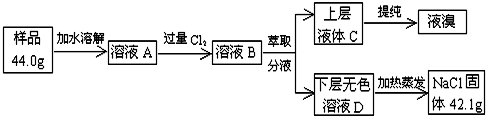
(4)写出Cl2通入溶液A中发生反应的离子方程式:___
(5)为了证明溶液D中几乎不存在Br-,可选用的试剂为___(填选项字母);
(A)碘水 (B)淀粉碘化钾溶液 (C)新制氯水和四氯化碳 (D)食盐水
据题中操作流程图所示,在萃取操作中应选取的有机溶剂为___;
(A)四氯化碳 (B)苯 (C)乙醇 (D)甘油
(6)试计算该食盐样品中氯化钠的质量分数为:___ (保留一位小数).

(1)将NaCl溶液进行电解,在电解槽的阴极发生的电极反应式___.原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是___(填序号)
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是:___.
某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如下实验装置:

(3)图中冷却水的出口为___(填写“甲”或“乙”编号).
实验装置气密性良好,要达到提纯溴的目的,操作的关键是___.C中液体的颜色为___.
从海水中提取的食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如图所示:

(4)写出Cl2通入溶液A中发生反应的离子方程式:___
(5)为了证明溶液D中几乎不存在Br-,可选用的试剂为___(填选项字母);
(A)碘水 (B)淀粉碘化钾溶液 (C)新制氯水和四氯化碳 (D)食盐水
据题中操作流程图所示,在萃取操作中应选取的有机溶剂为___;
(A)四氯化碳 (B)苯 (C)乙醇 (D)甘油
(6)试计算该食盐样品中氯化钠的质量分数为:___ (保留一位小数).
▼优质解答
答案和解析
海水经淡化后母液中含有溴离子,通入氯气,可得到低浓度的溴,然后通入空气吹出,进行富集,用碱溶液吸收,再通入氯气可得到浓度较大的溴,
(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,阴极发生的电极反应式为2Cl--2e-=Cl2,SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,最后加入盐酸,试剂添加的顺序可以为③①②,
故答案为:2Cl--2e-=Cl2;③①②;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:提高溴的富集程度;
(3)蒸馏时,为充分冷凝,冷凝水应从下端进,上端出,所以从冷却水的出口为甲,操作中控制关键条件是控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色或红棕色的液态溴单质,
故答案为:甲;控制温度59℃,使溴单质挥发;深棕红色或红棕色;
(4)NaBr的溶液中通入氯气,将溴离子氧化成溴单质,反应的离子方程式为2Br-+Cl2=Br2+2Cl-,
故答案为:2Br-+Cl2=Br2+2Cl-;
(5)新制氯水可氧化溴离子生成红褐色的单质溴,现象明显,用有机物萃取,下层为无色液体,故所用有机溶剂密度比水小,且与水不互溶,所以应用苯萃取,故选B,
故答案为:C;B;
(6)设样品中溴化钠的质量为xg,2NaBr+Cl2=2NaCl+Br2 △m
206 117 89
x 44-42.1=1.9
=
,x=4.4,故原固体混合物中氯化钠的质量分数为
=90.0%,
故答案为:90.0%.
(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,阴极发生的电极反应式为2Cl--2e-=Cl2,SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,最后加入盐酸,试剂添加的顺序可以为③①②,
故答案为:2Cl--2e-=Cl2;③①②;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:提高溴的富集程度;
(3)蒸馏时,为充分冷凝,冷凝水应从下端进,上端出,所以从冷却水的出口为甲,操作中控制关键条件是控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色或红棕色的液态溴单质,
故答案为:甲;控制温度59℃,使溴单质挥发;深棕红色或红棕色;
(4)NaBr的溶液中通入氯气,将溴离子氧化成溴单质,反应的离子方程式为2Br-+Cl2=Br2+2Cl-,
故答案为:2Br-+Cl2=Br2+2Cl-;
(5)新制氯水可氧化溴离子生成红褐色的单质溴,现象明显,用有机物萃取,下层为无色液体,故所用有机溶剂密度比水小,且与水不互溶,所以应用苯萃取,故选B,
故答案为:C;B;
(6)设样品中溴化钠的质量为xg,2NaBr+Cl2=2NaCl+Br2 △m
206 117 89
x 44-42.1=1.9
| 206 |
| x |
| 89 |
| 1.9 |
| 44.0-4.4 |
| 44.0 |
故答案为:90.0%.
看了 海水是巨大的资源宝库,从海水...的网友还看了以下:
暑假大本营上的一些地理题(1)“----------”不仅作为一项基本国策,更应落实到行动上.(2) 2020-03-31 …
(2013•黄冈一模)常温下,某溶液中由水电离c(H+)=1×10-13mol•L-1,下列各组中 2020-04-12 …
下列说法正确的是()A.25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×1 2020-04-12 …
100℃时,Kw=1.0×10-12(1)常温下水电离出的离子浓度符合c(H+)•c(OH-)=1 2020-04-12 …
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)•c(OH-)=1×10-20的溶液,其pH 2020-05-13 …
常温时,纯水中由水电离的c(OH-)=a,pH=1的盐酸中由水电离的c(OH-)=b,0.2mol 2020-05-23 …
常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的 2020-06-12 …
1.下列变化中,构成物质的微粒发生了本质变化的是( ) A.酒精和水的相互混合 B.糖溶解在1.下 2020-06-27 …
写出下列各列中能量的转化:1.水电站里水转机带动发电机发电。2.电动机带动水泵把水抽到高处。 2020-12-13 …
常温下,向20mL0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加 2021-01-12 …