早教吧作业答案频道 -->化学-->
肼()可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1②N2H4(l)+O2(g
题目详情
肼(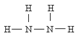 )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:___
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:___
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1中数据计算断裂1molN-H键所需的能量(kJ)是:___
(4)写出NH3与NaClO反应得到肼的化学方程式:___.
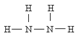 )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:___
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:___
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1中数据计算断裂1molN-H键所需的能量(kJ)是:___
(4)写出NH3与NaClO反应得到肼的化学方程式:___.
▼优质解答
答案和解析
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ∙mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(3)设断裂1molN-H键所需的能量为x,
由反应及焓变等于反应物中键能之和-生成物中键能之和可知,
4x+154+498-942-2×2×464=-534,
解得x=403(kJ),
故答案为:403;
(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ∙mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(3)设断裂1molN-H键所需的能量为x,
由反应及焓变等于反应物中键能之和-生成物中键能之和可知,
4x+154+498-942-2×2×464=-534,
解得x=403(kJ),
故答案为:403;
(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
看了肼()可作为火箭发动机的燃料,...的网友还看了以下:
数学这部是怎么因式分解的,没看懂?化简得:(k^2+1)x^2+(2k-2k^2)x+k^2-2k- 2020-03-30 …
已知被控对象差分方程:y(k)-0.6y(k-1)=0.u(k-1)(P7.2)(1)试写出系统在k 2020-03-30 …
分式求和问题1/(2^k+1)+1/(2^k+2)+…+1/2^(k+1)为什么1/(2^k+1) 2020-04-26 …
高二数学,不等式若关于x的不等式(1+k²)≤k^4+4解集是M,则对任意常数R,总有?A.2∈M 2020-05-13 …
用数学归纳法证明,1+X+X^2+...+X^N=1-X^N+1/1-X证:当N=1,左式=1+X 2020-08-01 …
用数学归纳法证明(n+1)(n+2)…(n+n)=2^n·1·3·……·(2n-1)(n∈N*), 2020-08-01 …
已知n为正偶数,用数学归纳法证明()1时,若已假设n=k(k≥2为偶数)时命题为真,则还需要用归纳 2020-08-01 …
1+2+3+4+5+.+n=0.5n^2+n1^2+2^2+3^2.+n^2=n(n+1)(2n+ 2020-08-03 …
已知n为正偶数,用数学归纳法证明1-12+13-14+…+1n−1=2(1n+2+1n+4+…+12 2020-11-07 …
1.二次三项式x^2+(k+2)x+k+1是完全平方公式,求K的值2.全国足球甲A联赛,规定每个队都 2020-12-31 …