早教吧作业答案频道 -->化学-->
奥地利化学家拜耳的“碱溶法”与法国化学家埃鲁的“电解法”相结合,奠定了现代电解冶炼铝工业方法的基础,电解铝的原料主要来自铝土矿(主要成分为Al2O3、Fe2O3、SiO2等),基本流程
题目详情
奥地利化学家拜耳的“碱溶法”与法国化学家埃鲁的“电解法”相结合,奠定了现代电解冶炼铝工业方法的基础,电解铝的原料主要来自铝土矿(主要成分为Al2O3、Fe2O3、SiO2等),基本流程及装置图如下.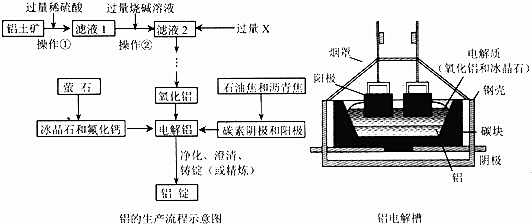
回答下列问题:
(1)操作①和操作②都是___(填操作名称),加入过量烧碱溶液时反应的离子方程式为___.
(2)加入过量X,发生反应的化学方程式为___.
(3)电解时,阳极的电极反应式为___,实际生产中阳极需要定期更换,原因是___.
(4)在电解槽的钢板和阴极碳素材料之间需要放置___(选填字母序号).
a、耐火绝缘 b、防爆导热 c、耐火导电 d、导热导电
(5)电解铝时,以氧化铝-冰晶石溶融液为电解质,其中也常加入少量的氟化钙,氟化钙的作用是___.为制取冰晶石,工业上采用氢氧化铝、纯碱和氟化氢在一定条件下充分混合反应制取冰晶石,该反应的化学方程式为___.
(6)上述流程生产1mol金属铝耗电能约1.8×106J.某铝土矿中氧化铝的质量分数为51%,则1吨该铝土矿冶炼金属铝耗电能___J;已知每个铝制易拉罐约15g,其中铝的质量分数为90%,由一只易拉罐回收生产金属铝耗电能约4.5×104J,则制得等量金属铝的能耗为上述流程生产方法的___%;通过对计算数据的分析,你能得到什么结论___.

回答下列问题:
(1)操作①和操作②都是___(填操作名称),加入过量烧碱溶液时反应的离子方程式为___.
(2)加入过量X,发生反应的化学方程式为___.
(3)电解时,阳极的电极反应式为___,实际生产中阳极需要定期更换,原因是___.
(4)在电解槽的钢板和阴极碳素材料之间需要放置___(选填字母序号).
a、耐火绝缘 b、防爆导热 c、耐火导电 d、导热导电
(5)电解铝时,以氧化铝-冰晶石溶融液为电解质,其中也常加入少量的氟化钙,氟化钙的作用是___.为制取冰晶石,工业上采用氢氧化铝、纯碱和氟化氢在一定条件下充分混合反应制取冰晶石,该反应的化学方程式为___.
(6)上述流程生产1mol金属铝耗电能约1.8×106J.某铝土矿中氧化铝的质量分数为51%,则1吨该铝土矿冶炼金属铝耗电能___J;已知每个铝制易拉罐约15g,其中铝的质量分数为90%,由一只易拉罐回收生产金属铝耗电能约4.5×104J,则制得等量金属铝的能耗为上述流程生产方法的___%;通过对计算数据的分析,你能得到什么结论___.
▼优质解答
答案和解析
铝土矿(主要成分为Al2O3、Fe2O3、SiO2等),加入过量稀硫酸,氧化铝、氧化铁溶解,二氧化硅不溶,过滤得到滤液1是氯化铝溶液、氯化铁溶液,加入过量氢氧化钠溶液发生反应生成氢氧化铁沉淀、偏铝酸钠溶液,过滤得到滤液2为偏铝酸钠溶液,通入过量的X为二氧化碳反应生成碳酸氢钠、氢氧化铝沉淀,过滤得到氢氧化铝沉淀受热分解生成氧化铝,通过加入冰晶石恒容氟化钙降低氧化铝熔点,以碳素做阴阳极,电解生成电解铝,净化、澄清、精炼得到铝锭,
(1)分析可知操作1和操作2是分离固体和溶液的操作为过滤,加入过量氢氧化钠溶液是铁离子生成氢氧化铁沉淀,铝离子和过量氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓,
故答案为:过滤;Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓;
(2)NaAlO2溶液中通入过量CO2生成Al(OH)3和NaHCO3,反应的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)电解原理可知阳极失氧化铝熔融后电离出的氧离子失电子生成氧气发生氧化反应,电极反应为:2O2--4e-=O2↑,实际生产中阳极需要定期更换是因为阳极上生成氧气会和材料中碳发生反应消耗电极,
故答案为:2O2--4e-=O2↑;阳极产生的氧气会与电极材料中的碳反应而使阳极损耗;
(4)依据电解原理分析可知,在电解槽的钢板和阴极碳素材料之间需要耐火绝缘,故选a,
故答案为:a;
(5)Al2O3的熔点很高,熔化需要较多能量,电解铝时,以氧化铝-冰晶石溶融液为电解质,其中也常加入少量的氟化钙,氟化钙的作用是帮助降低Al2O3的熔化温度;工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,根据质量守恒定律书写该化学方程式为:2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
故答案为:帮助降低氧化铝的熔点;2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
(6)某铝土矿中氧化铝的质量分数为51%,则1吨该铝土矿中氧化铝质量=1×106g,含铝物质的量=
=10000mol,生产1mol金属铝耗电能约1.8×106J.则1吨该铝土矿冶炼金属铝耗电能=1.8×106J×10000=1.8×1010J,已知每个铝制易拉罐约15g,其中铝的质量分数为90%,其中铝的物质的量=
=0.5mol,由一只易拉罐回收生,产金属铝耗电能约4.5×104J,生产1molAl耗电能=4.5×104J×
=9×104J,制得等量金属铝的能耗为上述流程生产方法耗能的
=5,通过对计算数据的分析,易拉罐的回收利用可以节约能源,
故答案为:1.8×1010;5;易拉罐的回收利用有利于节约能源;
(1)分析可知操作1和操作2是分离固体和溶液的操作为过滤,加入过量氢氧化钠溶液是铁离子生成氢氧化铁沉淀,铝离子和过量氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓,
故答案为:过滤;Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓;
(2)NaAlO2溶液中通入过量CO2生成Al(OH)3和NaHCO3,反应的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)电解原理可知阳极失氧化铝熔融后电离出的氧离子失电子生成氧气发生氧化反应,电极反应为:2O2--4e-=O2↑,实际生产中阳极需要定期更换是因为阳极上生成氧气会和材料中碳发生反应消耗电极,
故答案为:2O2--4e-=O2↑;阳极产生的氧气会与电极材料中的碳反应而使阳极损耗;
(4)依据电解原理分析可知,在电解槽的钢板和阴极碳素材料之间需要耐火绝缘,故选a,
故答案为:a;
(5)Al2O3的熔点很高,熔化需要较多能量,电解铝时,以氧化铝-冰晶石溶融液为电解质,其中也常加入少量的氟化钙,氟化钙的作用是帮助降低Al2O3的熔化温度;工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,根据质量守恒定律书写该化学方程式为:2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
故答案为:帮助降低氧化铝的熔点;2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
(6)某铝土矿中氧化铝的质量分数为51%,则1吨该铝土矿中氧化铝质量=1×106g,含铝物质的量=
| 1×106g×51% |
| 102g/mol |
| 15g×90% |
| 27g/mol |
| 1 |
| 0.5 |
| 9×104 |
| 1.8×106 |
故答案为:1.8×1010;5;易拉罐的回收利用有利于节约能源;
看了奥地利化学家拜耳的“碱溶法”与...的网友还看了以下:
电学s/d是什么单位呢?因为看到这样一句话.所测量的时基与23℃测量的时基差不超过3.28s/d这 2020-05-22 …
四个电阻值均为30欧,电压U为9V,当电键S断开时,电流表示数为?当电键S闭合时,电流表示数为?R 2020-06-07 …
如图所示电路中,电源的电动势E=6V,内阻r=1Ω;电阻R1=R2=3Ω,R3=6Ω.求下列各种情 2020-06-21 …
真空中有一均匀带正电球面,半径为R,电荷面密度为σ,在球面上挖去一小块面积(连同电荷)ΔS,则ΔS 2020-07-11 …
在常温常压下,已知:4Fe(s)+3O2(g)=2Fe2O3(s)ΔH14Al(s)+3O2(g) 2020-07-12 …
如图所示,电源的电动势E=110V,电阻R1=21Ω,电动机线圈的电阻R0=0.5Ω,当电键S断开 2020-07-19 …
在如图所示电路中,电源电压保持不变,电键S闭合,下列说法正确的是()A.将R1与闭合的电键S位置互 2020-07-20 …
如图所示,C为电容器,E为电源,S为单刀双向开关,A为小灯泡,电容器原来不带电,S为断开状态试分析: 2020-11-28 …
在图16所示的电路中,电源电压U=15V,电阻R1、R2、R3的阻值均为10Ω,S为单刀三掷电键,求 2020-11-28 …
在如图图示的电路中,电源电压U=15V,电阻R1、R2、R3的阻值均为10Ω,S为单刀三掷电键,求下 2020-11-28 …