早教吧作业答案频道 -->化学-->
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置.(1)连接好装置后,实验前必须进行的一步操作是.(回答操作名称,不必叙述操作细节)(2)实
题目详情
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置.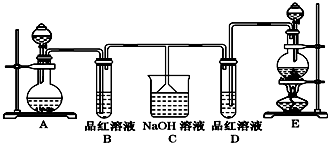
(1)连接好装置后,实验前必须进行的一步操作是___.(回答操作名称,不必叙述操作细节)
(2)实验室用Na2SO3与硫酸反应制备SO2,MnO2跟浓盐酸共热反应制备Cl2时.制备Cl2应选用上图A、E两发生装置中___装置(填装置序号),通过___(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的离子方程式为___.
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色.停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:___,D:___.
(4)实验小组利用下图所示装置探究两种气体按不同比例混合后的漂白性.
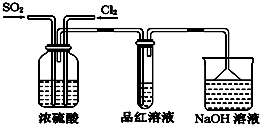
试分析:
①实验小组在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:___.(结合反应方程式回答).
②盛NaOH溶液的烧杯吸收尾气一段时间后,经分析:D中溶液仍呈强碱性,且一定存在Cl-、OH-和SO42-.对于可能存在的其他阴离子,小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
现限选以下试剂,设计实验方案,进行实验,请完善实验步骤并填写预期现象.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于F、G两试管中.
步骤二:向F试管中滴加少量___ (填序号),若溶液___(填现象),则假设1成立.
步骤三:向G试管中滴加少量___(填序号),若溶液___(填现象),则假设2成立.

(1)连接好装置后,实验前必须进行的一步操作是___.(回答操作名称,不必叙述操作细节)
(2)实验室用Na2SO3与硫酸反应制备SO2,MnO2跟浓盐酸共热反应制备Cl2时.制备Cl2应选用上图A、E两发生装置中___装置(填装置序号),通过___(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的离子方程式为___.
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色.停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:___,D:___.
(4)实验小组利用下图所示装置探究两种气体按不同比例混合后的漂白性.

试分析:
①实验小组在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:___.(结合反应方程式回答).
②盛NaOH溶液的烧杯吸收尾气一段时间后,经分析:D中溶液仍呈强碱性,且一定存在Cl-、OH-和SO42-.对于可能存在的其他阴离子,小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
现限选以下试剂,设计实验方案,进行实验,请完善实验步骤并填写预期现象.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于F、G两试管中.
步骤二:向F试管中滴加少量___ (填序号),若溶液___(填现象),则假设1成立.
步骤三:向G试管中滴加少量___(填序号),若溶液___(填现象),则假设2成立.
▼优质解答
答案和解析
(1)该实验装置中连接了多个仪器,且氯气、二氧化硫有毒气体,不避免氯气、二氧化硫泄漏,会污染空气且浪费试剂,所以在实验前需要检验装置气密性,
故答案为:检查装置的气密性;
(2)实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,故选E;
用分液漏斗向烧瓶中加入适量的浓盐酸,加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,离子反应方程式为:MnO2+4H++2Cl-
Mn 2++Cl2↑+2H2O,
故答案为:E;分液漏斗;4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O;
(3)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:恢复红色;无变化;
(4)①氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应SO2+Cl2+2H2O═2HCl+H2SO4,而使气体失去漂白性,
故答案为:SO2和Cl2按1:1混合时,发生反应:SO2+Cl2+2H2O═2HCl+H2SO4,使混合气体失去漂白作用;
②步骤二:KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O,KMnO4褪色,
故答案为:b;褪色;
步骤三:ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色,
故答案为:d;变蓝色.
故答案为:检查装置的气密性;
(2)实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,故选E;
用分液漏斗向烧瓶中加入适量的浓盐酸,加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,离子反应方程式为:MnO2+4H++2Cl-
| ||
故答案为:E;分液漏斗;4H++2Cl-+MnO2
| ||
(3)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:恢复红色;无变化;
(4)①氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应SO2+Cl2+2H2O═2HCl+H2SO4,而使气体失去漂白性,
故答案为:SO2和Cl2按1:1混合时,发生反应:SO2+Cl2+2H2O═2HCl+H2SO4,使混合气体失去漂白作用;
②步骤二:KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O,KMnO4褪色,
故答案为:b;褪色;
步骤三:ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色,
故答案为:d;变蓝色.
看了某化学实验小组同学为了证明、比...的网友还看了以下:
进入化学实验室必须执行规范的实验操作程序,否则许多实验都可能引发事故。下列装置所示的化学实验中,一 2020-05-02 …
下列关于算法的说法中不正确的是()①求解某一类问题的算法是唯一的;②算法必须在有限步操作之后停止; 2020-05-14 …
豌豆的高茎(D)对矮茎(d)为一对相对性状.仔细观察下列实验过程图解,回答相关问题:(1)该实验的 2020-05-17 …
实验时,必须严格遵守实验操作要求和实验的().使用危险品前,必须看清物品上的()标志.在实验过程中 2020-06-11 …
豌豆的高茎(D)对矮茎(d)为一对相对性状.仔细观察下列实验过程图解,回答相关问题:(1)该实验的 2020-07-05 …
在做化学实验时必须注意安全操作,下列实验操作或事故处理正确的是()①在点燃易燃气体前,必须检验气体 2020-07-06 …
(1)某位同学在做验证牛顿第二定律实验时,实验前必须进行的操作步骤是.(2)正确操作后通过测量,作出 2021-01-01 …
在化学实验中必须注意安全操作。下列实验操作及注意事项正确的是①制取气体之前,都要先检查装置的气密性② 2021-01-01 …
在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理中不正确的是()A.在点燃易燃气体 2021-01-01 …
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置.(1)连接好装置后, 2021-01-12 …