早教吧作业答案频道 -->化学-->
(2013?汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:反应Ⅰ:CO(g)+2H2(g)?CH3OH
题目详情
 (2013?汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2013?汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是__(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为__,此时的温度为__(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__
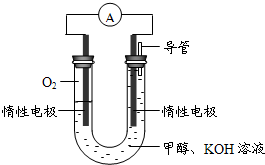
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为__.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为__.
▼优质解答
答案和解析
分析:(1)①原子经济性原则指的是原子利用率高的反应;②对于放热反应,温度越高则平衡常数越小;③根据化学方程式计算平衡转化率和化学平衡常数进而确定反应的温度;(2)根据盖斯定律来计算化学反应的焓变,书写热化学方程式;(3)极是氧气发生得电子的还原反应,总反应是燃料燃烧的反应.(1)①原子经济性原则指的是原子利用率高的反应,Ⅰ是化合反应,原子利用率高达100%,故答案为:Ⅰ;②根据表中数据可以看出,温度越高则平衡常数越小,可以确定该反应是放热反应,故答案为:<;③设一氧化碳的变化量为x,则 CO(g)+2H2(g)?CH3OH(g)初始浓度(mol/L) 1 3 0 变化浓度(mol/L) 0.8 1.6 0.8平衡浓度(mol/L) 0.2 2.4 0.8则CO的转化率=0.81×100%=80%,平衡常数K=[CH3OH][CO][H2]2=0.80.2×2.42=2.041,所以该反应的温度为250℃,故答案为:80%;250℃;(2)甲醇不完全燃烧生成一氧化碳和液态水的反应CH3OH(l)+O2(g)=CO(g)+2H2O(l)和反应①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol,②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③H2O(g)=H2O(l)△H=-44.0kJ/mol之间的关系为:①×12-②×12+2×③=-442.8 kJ∕mol,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol;(3)①在燃料电池中,正极是氧气发生得电子的还原反应,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-; ②工作一段时间后,测得溶液的pH减小,说明氢氧根离子被消耗,在在燃料电池中,总反应是燃料燃烧的反应,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O.点评:本题是一道涉及电化学、热化学、化学平衡知识的综合题目,考查角度广,难度大.
看了(2013?汕尾二模)能源短缺...的网友还看了以下:
(1)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来 2020-04-11 …
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2) 2020-05-14 …
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2( 2020-05-16 …
现有下列反应H2(g)+CO2(g)=H2O(g)+CO(g),此反应在1259K下达到平衡.现有 2020-05-23 …
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO 2020-06-23 …
将不同物质的量的H2O(g)和CO分别通入到1L某恒容密闭容器中进行反应:H2O(g)+CO(g) 2020-07-03 …
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO 2020-07-16 …
CO和H2可作为能源和化工原料,应用十分广泛。(1)已知:C(s)+O2(g)===CO2(g)△ 2020-07-17 …
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采 2020-11-26 …
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。已知:CH4(g)+H2O(g) 2021-01-11 …