25℃时,某一元弱酸HA的电离平衡常数为Ka,A‑的水解平衡常数为Kh,该温度下向20mL0.lmol•L-1HA溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略反应导致的温度变化).
25℃时,某一元弱酸HA的电离平衡常数为Ka,A‑的水解平衡常数为Kh,该温度下向20mL 0.lmol•L-1 HA溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略反应导致的温度变化).下列说法不正确的是( )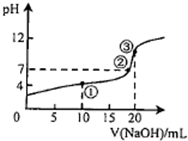
A. 滴定过程中总是存在:Ka>Kh
B. 点②所示溶液中存在:c(Na+)=c(A-)
C. 点③所示溶液中存在:c(Na+)=c(A-)+c(HA)
D. 向点①所示溶液中加水:
比值减小c(A-) c(OH-)•c(HA)
B.点②溶液pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(A-),故B正确;
C.点③酸碱恰好反应生成NaA,溶液中存在物料守恒,根据物料守恒得c(Na+)=c(A-)+c(HA),故C正确;
D.平衡常数只与温度有关,温度不变,电离平衡常数、离子积常数不变,所以
| c(A-) |
| c(OH-)•c(HA) |
| c(A-).c(H+) |
| c(OH-).c(H+).c(HA) |
| Ka |
| Kw |
故选D.
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.(1)SCR(选择性催化还原) 2020-06-11 …
下列图示与对应的叙述相符的是()A.图1表示1LpH=2的CH3COOH溶液加水稀释至VL,pH随 2020-06-13 …
下列物质中1硫粉2水3液态空气4暗紫色的高锰酸钾完全分解所残余的固体5二氧化硫6铜7过氧化氢属于单 2020-06-14 …
判断对错将一条纱布的下端放入水中,由于水在水中会形成一个个小弯曲面,使得弯曲液下面的压强小于液面上 2020-06-19 …
将一条纱布条的下端放入水中,由于水在纱布里会形成一个个小弯曲面,使得弯曲液面小的压强小于液面上的大 2020-06-19 …
环境监察的题目.求大神呐~helpme!SOSOSOSOSOSOS.25℃时,Br2在CCI4和水 2020-06-28 …
从聚乙烯醇的4.2%水溶液里再配成1%、2%、3%、3.5%100毫升,怎么配?” 2020-07-05 …
下列图示与对应的叙述相符的是()A.图1表示1LpH=2的CH3COOH溶液加水稀释至VL,pH随 2020-07-22 …
甲、乙物质在不同温度4的溶解度如2所示.请根据溶解度曲线回答4列问题:(1)从乙的溶液中得到乙晶体的 2021-01-15 …
求下列有机物1.不易燃烧,反用于灭火的有机物有什么?2.水溶液能够导电的有机物有什么?3.属于离子晶 2021-02-01 …