早教吧作业答案频道 -->化学-->
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d(n+6)ns1.由它们组成的配位化合物X
题目详情
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
(1)该配位化合物X的化学式为___.
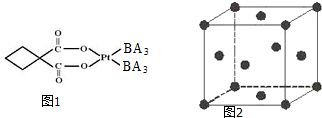
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图1,其中碳原子的杂化方式有___.
(3)D元素原子的最外层电子轨道表式为___.
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为___.
(5)元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2),氰氨化钙和水反应可生成NH3.与CN22-互为等电子体的分子有___(填写一种化学式即可);写出CaCN2水解反应的化学方程式___.
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式___.单质E的晶胞如图2所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ=___g/cm3.

(1)该配位化合物X的化学式为___.
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图1,其中碳原子的杂化方式有___.
(3)D元素原子的最外层电子轨道表式为___.
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为___.
(5)元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2),氰氨化钙和水反应可生成NH3.与CN22-互为等电子体的分子有___(填写一种化学式即可);写出CaCN2水解反应的化学方程式___.
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式___.单质E的晶胞如图2所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ=___g/cm3.
▼优质解答
答案和解析
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,符合条件的只有O和S元素,则C是O元素、D是S元素;
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,所以该分子中C原子杂化方式为sp2杂化和sp2杂化,故答案为:sp2杂化和sp2杂化;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子,其最外层电子排布图为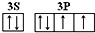 ,故答案为:
,故答案为: ;
;
(4)氢键的存在导致物质溶解性增大,H和O元素组成的水和双氧水之间能形成氢键,所以二者能以任意比互溶,故答案为:H2O与H2O2之间形成氢键;
(5)价层电子数相等、原子个数相等的微粒互为得电子体,则与CN22-互为等电子体的分子有CO2或N2O;碳化钙和水反应生成乙炔和氢氧化钙,则CaCN2和水反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,故答案为:CO2或N2O; CaCN2+3H2O=CaCO3+2NH3↑;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水,反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
该晶胞的体积为a3cm3,根据ρ=
=
g/cm3=
g/cm3,故答案为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
.
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,所以该分子中C原子杂化方式为sp2杂化和sp2杂化,故答案为:sp2杂化和sp2杂化;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子,其最外层电子排布图为
 ,故答案为:
,故答案为: ;
;(4)氢键的存在导致物质溶解性增大,H和O元素组成的水和双氧水之间能形成氢键,所以二者能以任意比互溶,故答案为:H2O与H2O2之间形成氢键;
(5)价层电子数相等、原子个数相等的微粒互为得电子体,则与CN22-互为等电子体的分子有CO2或N2O;碳化钙和水反应生成乙炔和氢氧化钙,则CaCN2和水反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,故答案为:CO2或N2O; CaCN2+3H2O=CaCO3+2NH3↑;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水,反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
该晶胞的体积为a3cm3,根据ρ=
| m |
| V |
| ||
| a3 |
| 4M |
| NA×a3 |
| 4M |
| NA×a3 |
看了前四周期的五种元素A、B、C、...的网友还看了以下:
正常发光电阻与发光较暗电阻哪个大?正常发光电阻与发光变亮电阻哪个大?对于同一个灯泡来说的 2020-04-13 …
A、Z、R、D、E、F、G是七种原子序数依次增大且不大于20的元素,其中有两种非金属元素位于同一主 2020-05-17 …
分析材料,写出你的探究结果。1979—2007年,我国国内生产总值年均实际增长9.8%,大大高于同 2020-06-21 …
下列有关生物体内化学元素的叙述错误的是()A.同一生物体不同组织细胞内化学元素种类和含量大体相同B 2020-07-29 …
(2014•湖北模拟)前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周 2020-11-17 …
X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相 2020-12-05 …
A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子 2020-12-05 …
英语翻译我们为了顾全大局,于同年秋末在第三方的调停下开诚布公的多次强烈要求对方赔偿我们的一切损失. 2020-12-14 …
改革开放以来的30年,我国国内生产总值(GDP)年平均增长9.7%,是新中国成立五十多年来发展最快的 2020-12-31 …
在电工学中常用物理量“电导”(符号为G)导电能力越强,G越大.对于同一导体,G和R的关系式G=1除以 2021-01-13 …