早教吧作业答案频道 -->化学-->
科研生产中常涉及碳的化合物.请回答下列问题:(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),反应过程中测定的部分数据见表
题目详情
科研生产中常涉及碳的化合物.请回答下列问题:
(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
①反应在t1 min内的平均速率为v(H2)=___;判定t1达平衡状态的理由是___.
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=___.
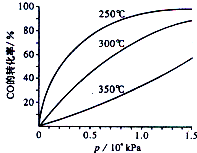
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H___0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是___.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).

(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=___.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H___0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是___.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).
▼优质解答
答案和解析
(1)①v(CO)=
=
mol/(L.min),速率之比等于化学计量数之比,则v(H2)=(CO)=
mol/(L.min);
t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化,说明t1 min时到达平衡,
故答案为:
mol/(L.min);t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化;
②CO、H2O按1:1反应,与原平衡相比二者物质的量互换,由于平衡常数不变,则平衡时二氧化碳的浓度相等,则达平衡时,CO2的物质的量浓度c(CO2)=
=0.2mol/L,
故答案为:0.2mol/L;
(2)由图可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应故△H<0;
在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本,故选择1.3×l04kPa左右,
故答案为:<;在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本;
(3)将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,则:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量(mol/L):x x 0 0
转化量(mol/L):0.1 0.1 0.1 0.3
平衡量(mol/L):x-0.1 x-0.1 0.1 0.3
故
=27,解得x=0.11,
则CH4的平衡转化率为
×100%≈90.91%,
答:CH4的平衡转化率为90.91%.
| ||
| t1min |
| 0.2 |
| t1 |
| 0.2 |
| t1 |
t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化,说明t1 min时到达平衡,
故答案为:
| 0.2 |
| t1 |
②CO、H2O按1:1反应,与原平衡相比二者物质的量互换,由于平衡常数不变,则平衡时二氧化碳的浓度相等,则达平衡时,CO2的物质的量浓度c(CO2)=
| 1.8mol-1.2mol |
| 3L |
故答案为:0.2mol/L;
(2)由图可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应故△H<0;
在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本,故选择1.3×l04kPa左右,
故答案为:<;在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本;
(3)将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,则:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量(mol/L):x x 0 0
转化量(mol/L):0.1 0.1 0.1 0.3
平衡量(mol/L):x-0.1 x-0.1 0.1 0.3
故
| 0.1×0.33 |
| (x-0.1)×(x-0.1) |
则CH4的平衡转化率为
| 0.1mol/L |
| 0.11mol/L |
答:CH4的平衡转化率为90.91%.
看了科研生产中常涉及碳的化合物.请...的网友还看了以下:
已知圆x^2+y^2=3,过点P(1,3)作直线交于A,B两点,在AB上有一点Q,使向量PA=h向 2020-04-12 …
一足够深的薄壁柱形容器的底面积当向容器内注入深度一足够深的簿壁柱形容器的底面积S1=500cm`2 2020-05-17 …
有一个如图所示的两端开口的弯管形容器,从粗端向容器中灌水,在细端用一个横截面是0.01m2质量是l 2020-06-03 …
如图所示LC振荡电路,C为可变电容器,线圈L1的电感量为300μH,L2的电感量为30μH.(1) 2020-06-21 …
在一定温度下,向容积固定不变的密闭容器中充入amolNO2,发生如下反应:2NO2(g)⇌N2O4 2020-07-15 …
已知工业合成氨:2N2(g)+6H2(g)⇌4NH3(g)△H=-184.8kJ/mol.一定条件 2020-07-18 …
有一个如图所示的两端开口的弯管型容器,从粗端向容器中灌水,在细端用一个横截面积是0.01m2的活塞堵 2020-11-04 …
以等容量Q(t)向容器内注水至注满,h'(t)为容器中水平面高度h(t)随时间t的变化率,则反映h' 2020-11-26 …
初中二次函数y=a(x-h)^2+k向左移我觉得应该是(x+h)向右移动应该是y=(x-h)对称轴应 2020-12-07 …
在恒容的密闭容器中,可逆反应X(s)+Y(g)=2Z(g)▷H>0达到平衡时,下列说法正确的是A:充 2020-12-22 …