早教吧作业答案频道 -->化学-->
研究发现钼酸钠可减缓金属的腐蚀速率.工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4•2H2O)的途径如图1所示:回答下列问题:Ⅰ.(1)
题目详情
研究发现钼酸钠可减缓金属的腐蚀速率.工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4•2H2O)的途径如图1所示:
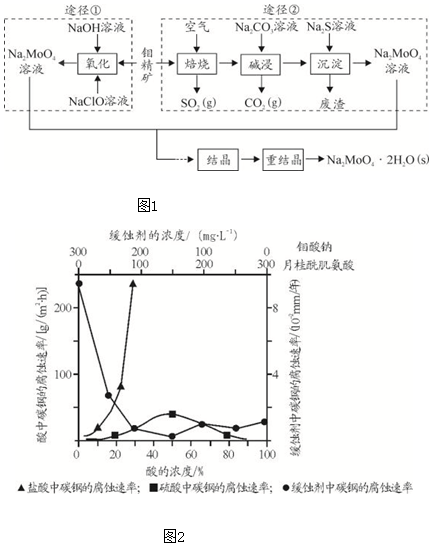
回答下列问题:
Ⅰ.(1)图下列标志中,应贴在保存NaClO容器上的是___.

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有___.
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为___.
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___ .
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率为___%.(保留三位有效数字).
Ⅱ.(1)如图2,碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___.
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为___(保留三位有效数字).

回答下列问题:
Ⅰ.(1)图下列标志中,应贴在保存NaClO容器上的是___.

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有___.
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为___.
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___ .
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率为___%.(保留三位有效数字).
Ⅱ.(1)如图2,碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___.
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为___(保留三位有效数字).
▼优质解答
答案和解析
I.(1)NaClO是一种强氧化剂,所以贴在装有NaClO容器上的是B;
故答案为:B;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
故答案为:充分粉碎矿石或逆流焙烧;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)由于母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
故答案为:母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(5)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=
molL=1×10-7mol/L,
溶液中硫酸根离子的浓度为:c(SO42-)=
mol/L=1.1×10-3mol/L,
硫酸根离子的去除率为:1-
×100%=1-2.75%≈97.3%;
故答案为:97.3%;
II.(1)由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢;
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
(2)根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:
≈7.28×10-4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1;
故答案为:7.28×l0-4mol•L-1.
故答案为:B;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
故答案为:充分粉碎矿石或逆流焙烧;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)由于母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
故答案为:母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(5)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=
| 4.0×10-8 |
| 0.40 |
溶液中硫酸根离子的浓度为:c(SO42-)=
| 1.1×10-10 |
| 1×10-7 |
硫酸根离子的去除率为:1-
| 1.1×10-3 |
| 0.04 |
故答案为:97.3%;
II.(1)由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢;
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
(2)根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:
| 150×10-3 |
| 206g/mol |
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1;
故答案为:7.28×l0-4mol•L-1.
看了研究发现钼酸钠可减缓金属的腐蚀...的网友还看了以下:
关于Cl[2]O的一道题Cl[2]O常用NaClO[3]和Na[2]SO[3]溶液混合并加H[2] 2020-04-11 …
已知二次函数y=ax2+bx+c的图象经过点A(3,0),B(2,-3),C(0,-3).(1)求 2020-04-25 …
如图为一健身器材模型,杠杆AB可绕O点在竖起平面内转动,OA:OB=1:4,质量为60kg的小明站 2020-05-13 …
O、A、B、C为空间四个点,又OA、OB、OC为空间的一个基底,则()A.O、A、B、C四点不共线 2020-05-14 …
∵EM是⊙O的切线,怎么推出EB•EC=EM2①?,看题后回答.(2005•温州)如图,已知四边形 2020-05-21 …
无穷小量的问题:o(x^2)/o(x)=o(x)是否成立? 2020-06-05 …
1、两圆的圆心距为14cm,内公切线长四倍根号六cm,两圆的半径之差为4cm。求:两圆半径。2、圆 2020-06-06 …
大气臭氧层的反应是:O+O3=2O2△H,该反应的能量变化如图所示,下列叙述中,正确的是()A.O+ 2020-10-31 …
1.已知平面内三个已知点A(1,7),B(0,0),C(8,3),D为线段BC上的一点,且有(向量B 2020-12-25 …
如图矩形ABCD中AB=6BC=2√3点O是AB的中点点P在AB的延长线上且BP=3一动点E从O点出 2021-01-02 …