早教吧作业答案频道 -->化学-->
最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐.MnFe2O4的制备流程如下:(1)原料Fe(NO3)n中n=,投入原料Fe(NO3)n和Mn(NO3
题目详情
最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐.MnFe2O4的制备流程如下:
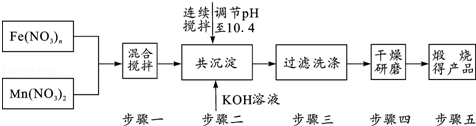
(1)原料Fe(NO3)n中n=___,投入原料Fe(NO3)n和Mn(NO3)2的质量之比应为___.
(2)步骤二中“连续搅拌”的目的是___; 步骤三中洗涤干净的标准___.
(3)利用MnFe2O4热化学循环制氢的反应可表示为
MnFe2O4
MnFe2O4-x+
O2↑;
MnFe2O4-x+xH2O→MnFe2O4+xH2↑.
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为___.
②该热化学循环新氢法的优点有___(答两点即可).
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___.

(1)原料Fe(NO3)n中n=___,投入原料Fe(NO3)n和Mn(NO3)2的质量之比应为___.
(2)步骤二中“连续搅拌”的目的是___; 步骤三中洗涤干净的标准___.
(3)利用MnFe2O4热化学循环制氢的反应可表示为
MnFe2O4
| 100K |
| |
| x |
| 2 |
MnFe2O4-x+xH2O→MnFe2O4+xH2↑.
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为___.
②该热化学循环新氢法的优点有___(答两点即可).
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___.
▼优质解答
答案和解析
(1)Mn为+2价,则MnFe2O4中Fe的化合价为+3价,则Fe(NO3)n中n=3;
由MnFe2O4中可知:Fe和Mn的个数之比为2:1,所以Fe(NO3)3与Mn(NO3)2 二者的物质的量之比 2:1,质量比为(242×2):(179×1)=484:179;
故答案为:3;484:179;
(2)连续搅拌是为了让Fe(NO3)n和Mn(NO3)2充分反应,由于溶液显碱性,则洗涤至洗涤液为中性时,说明沉淀上没有溶液中的离子,即沉淀已经洗涤干净,
故答案为:充分反应、沉淀完全;洗涤至流出液呈中性;
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有:x=y=2,2x+3y=4.4,解得:x=1.6,y=0.4,
则1 mol MnFe2O4-0.8中含Fe2+的物质的量为1.6 mol,则Fe2+占的百分率为
×100%=80%,
故答案为:80%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等,
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等;
③因高温消耗较多的能源,则寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物,
故答案为:寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物.
由MnFe2O4中可知:Fe和Mn的个数之比为2:1,所以Fe(NO3)3与Mn(NO3)2 二者的物质的量之比 2:1,质量比为(242×2):(179×1)=484:179;
故答案为:3;484:179;
(2)连续搅拌是为了让Fe(NO3)n和Mn(NO3)2充分反应,由于溶液显碱性,则洗涤至洗涤液为中性时,说明沉淀上没有溶液中的离子,即沉淀已经洗涤干净,
故答案为:充分反应、沉淀完全;洗涤至流出液呈中性;
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有:x=y=2,2x+3y=4.4,解得:x=1.6,y=0.4,
则1 mol MnFe2O4-0.8中含Fe2+的物质的量为1.6 mol,则Fe2+占的百分率为
| 1.6 |
| 2 |
故答案为:80%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等,
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等;
③因高温消耗较多的能源,则寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物,
故答案为:寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物.
看了最近的研究发现,复合氧化物铁酸...的网友还看了以下:
f(x)=2^(2-x)求导,其实这是一道数列题造出的函数,其中x本来是k,(k∈N+),用复合函 2020-04-09 …
DNA复制有关的计算规律m代表腺嘌呤在一个DNA分子中的数量,n代表复制的次数,那么DNA第n次复 2020-05-14 …
具有N个碱基对的一个DNA分子片段中,含有m个腺嘌呤脱氧核苷酸 该片段完成n次复制具有N个碱基对的 2020-05-17 …
26届联合国大会上决议“恢复”我国在联合国的权利,用恢复一词的原因是:1中国是联合国家宣言的签字国 2020-05-21 …
生物复制n次和第n次复制的区别世上说DNA分子复制的规律需要注意:若DNA分子中有某碱基M个,则第 2020-06-16 …
那请问一下f(x)=x^n-1的整个实数域上的根式1,还有在复数域的根在复数域上,恒有n个复根.记 2020-06-25 …
含有n个腺嘌呤的dna分子第n次复制,其实就是有2n-1个dna分子在复制,每个需要n个腺嘌呤脱氧 2020-07-05 …
集合{1,2,3.3n}可以划分成n个互不相交的三元集合{x,y,z},其中x+y=3z,求满足的 2020-08-02 …
复合函数的高阶求导问题!课本上给出了1/x的高阶求导公式(-1)^n*n!/(x)^(n+1)复合 2020-08-02 …
某DNA分子含m对碱基,其中A有a个,这DNA连续复制过程最这DNA连续复制对包嘧啶描述不正确的是A 2021-01-14 …