早教吧作业答案频道 -->化学-->
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:已知25℃,部分物质的溶度积常数如表:物质Mn(OH)2Co(OH
题目详情
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
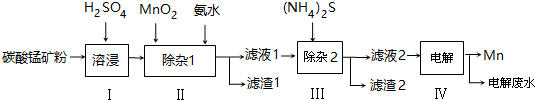
已知25℃,部分物质的溶度积常数如表:
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是:___.(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为___(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为___.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是___.
(4)滤液2中,c(Co2+):c(Ni2+)=___.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为___.(用含a、b、c的式子表达,无需化简)

已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为___(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为___.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是___.
(4)滤液2中,c(Co2+):c(Ni2+)=___.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为___.(用含a、b、c的式子表达,无需化简)
▼优质解答
答案和解析
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等,
故答案为:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,
故答案为:Fe(OH)3;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Cu2+、Zn2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失,
故答案为:若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1,
故答案为:5:1;
(5)滤渣1为为Fe(OH)3,质量为c kg,则n(Fe3+)=n(Fe(OH)3)=
mol,由2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O可知n(MnO2)=
×
mol,
将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg,n(Mn)=
mol,
可知n(MnCO3)=
mol-
×
mol,
m(MnCO3)=(
mol-
×
mol)×115g/mol,
则原碳酸锰矿中MnCO3的质量分数为
×100%,
故答案为:
×100%.
故答案为:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,
故答案为:Fe(OH)3;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Cu2+、Zn2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失,
故答案为:若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1,
故答案为:5:1;
(5)滤渣1为为Fe(OH)3,质量为c kg,则n(Fe3+)=n(Fe(OH)3)=
| 1000c |
| 107 |
| 1 |
| 2 |
| 1000c |
| 107 |
将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg,n(Mn)=
| 1000b |
| 55 |
可知n(MnCO3)=
| 1000b |
| 55 |
| 1 |
| 2 |
| 1000c |
| 107 |
m(MnCO3)=(
| 1000b |
| 55 |
| 1 |
| 2 |
| 1000c |
| 107 |
则原碳酸锰矿中MnCO3的质量分数为
(b-
| ||||||
| a |
故答案为:
(b-
| ||||||
| a |
看了锰的用途非常广泛,以碳酸锰矿(...的网友还看了以下:
短周期元素X和Y能形成XY4,若X的原子系数为m,Y的原子序数为n则m和n的关系式不可能是A.m- 2020-04-08 …
5^n+C(n,1)5^(n-1)+C(n,2)5^(n-2)+.C(n,n-1)5 被7除所得的 2020-05-16 …
求教数学题一道如果n是一个大于6的整数,那下面哪一个一定能被3整除?A.N*(N+5)(N-6)B 2020-06-12 …
大量氢原子处于n=5的激发态,它们自发地跃迁到低能级,在多种可能的跃迁中,设从n=5直接跃迁到n= 2020-06-26 …
高二解不等式C(n-5)n>C3(n-2)+2C2(n-2)+n-2解不等式C(n-5)n>C3( 2020-07-09 …
若某共价化合物分子中只含有C、H、O、N四种元素,且以n(C)、n(N)、n(O)分别表示C、N、 2020-07-20 …
数学排列组合及概率问题公式的请教小弟不明白两条公式的具体应用A(M,N)=P(M,N)=N(N-1) 2020-12-05 …
下列推断中,符合实际的是()A.第n周期的最后一种金属元素位于第n主族(n>1)B.第n周期有(8- 2020-12-07 …
(6分)氢原子从n=4的激发态直接跃迁到n=2的能态时,发出蓝色光,则氢原子从n=5的激发态直接跃迁 2020-12-27 …
1999年曾报导合成和分离了含高能量正离子N+5的化合物N5AsF6,下列叙述错误的是()A.N+5 2021-01-13 …