早教吧作业答案频道 -->化学-->
锰是冶炼工业中常用的添加剂.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:已知25℃,部分物质的溶度积常数如下:物质Mn(O
题目详情
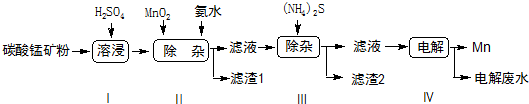
锰是冶炼工业中常用的添加剂.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是___.
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,则该反应过程中的离子方程式是___,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是___.
(4)步骤Ⅳ中,在___(填“阴”或“阳”)极析出Mn,电极反应方程式为___.
(5)已知:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热△H=___.
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,则除杂质时,所引入的锰元素相当于MnO2___kg.[MnCO3摩尔质量115g/mol,MnO2摩尔质量87g/mol].

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,则该反应过程中的离子方程式是___,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是___.
(4)步骤Ⅳ中,在___(填“阴”或“阳”)极析出Mn,电极反应方程式为___.
(5)已知:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热△H=___.
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,则除杂质时,所引入的锰元素相当于MnO2___kg.[MnCO3摩尔质量115g/mol,MnO2摩尔质量87g/mol].
▼优质解答
答案和解析
(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
故答案为:阴,Mn2++2e-=Mn;
(5)①S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
②Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
③MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热
盖斯定律计算得到②-①-③得到Mn(s)+O2(g)=MnO2(s)△H=-( a+c-b)kJ•mol-1
故答案为:-(a+c-b) kJ•mol-1;
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,除杂质时,所引入的锰元素和原来碳酸锰中锰元素总和为110b kg,设引入的锰元素相当于MnO2物质的量为x,
+x=
x=
-
相当于MnO2质量=(
-
)×87=(174b-0.435a )kg
故答案为:174b-0.435a;
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
故答案为:阴,Mn2++2e-=Mn;
(5)①S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
②Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
③MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热
盖斯定律计算得到②-①-③得到Mn(s)+O2(g)=MnO2(s)△H=-( a+c-b)kJ•mol-1
故答案为:-(a+c-b) kJ•mol-1;
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,除杂质时,所引入的锰元素和原来碳酸锰中锰元素总和为110b kg,设引入的锰元素相当于MnO2物质的量为x,
| a×57.5% |
| 115 |
| 110b |
| 55 |
x=
| 110b |
| 55 |
| a×57.5% |
| 115 |
相当于MnO2质量=(
| 110b |
| 55 |
| a×57.5% |
| 115 |
故答案为:174b-0.435a;
看了锰是冶炼工业中常用的添加剂.以...的网友还看了以下:
真心请求给位大侠帮帮忙!好的追分!已知(m+n)的2次方=16(m-n)的2次方=4,求mn的值. 2020-05-21 …
近日,我国科学家研发的比传统锌锰电池能量更高的铝锰电池已取得突破性进展.铝锰电池以氯化钠和稀氨水混 2020-07-05 …
已知两个等差数列{an}与{bn},它的前n项和分别为Sn、S”n,已知Sn/S'n=n+3/n+ 2020-07-09 …
几道估值的数学问题,悬赏30哦谢谢已知N=1+1/5+1/11+1/19+1/29+1/41+.+ 2020-07-15 …
(1/2)求解一道题,已知矩形ABCD,P是ABCD外一点,PA垂直ABCD,M,N分别为PC,P 2020-08-01 …
关于比例选段的题,已知mn=ab,将它改写成比例式,使n放在第四比例项是已知a=5m,b=5cm, 2020-08-03 …
奖分高1.已知m+m分之1=3则m的平方+m的平方分之一的值是?A.9B.11C.7D.12.(x+ 2020-11-01 …
已知废旧普通干电池筒内主要有木炭粉、淀粉、二氧化锰、氯化锌、氯化铵等物质,某化学兴趣小组同学欲通过实 2020-11-27 …
近日,我国科学家研发的比传统锌锰电池能量更高的铝锰电池已取得突破性进展.铝锰电池以氯化钠和稀氨水混合 2020-12-04 …
3道初二数学题(关于分式的)1.已知n分之m等于3分之5,求(m+n)分之m加上(m-n)分之m再减 2020-12-17 …