早教吧作业答案频道 -->化学-->
硫-碘循环分解水制氢主要涉及下列反应:ISO2+2H2O+I2═H2SO4+2HIII2HI⇌H2+I2III2H2SO4═2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是.a.反应III易在常温下进行b.反应I中SO2氧化性
题目详情
硫-碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2═H2SO4+2HI
II 2HI⇌H2+I2
III 2H2SO4═2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是___.
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2Od.循环过程中产生1molO2的同时产生1molH2
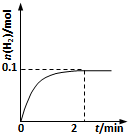
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=___.该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=___.相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则___是原来的2倍.
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___移动(填“向左”“向右”或“不”);若加入少量下列试剂中的___,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池.
已知 2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___.
I SO2+2H2O+I2═H2SO4+2HI
II 2HI⇌H2+I2
III 2H2SO4═2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是___.
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2Od.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=___.该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=___.相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则___是原来的2倍.
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___移动(填“向左”“向右”或“不”);若加入少量下列试剂中的___,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池.
已知 2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___.

▼优质解答
答案和解析
(1)a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
=0.1mol/L,用氢气表示的化学反应速率为
=0.05mol/(L.min),
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min);根据方程式计算平衡浓度,c(H2)=0.1mol/L,c(I2)=0.1mol/L,c(HI)=0.8mol/L,写出平衡常数表达式计算:K=
=
=
,则该温度下,H2(g)+I2(g)⇌2HI(g)的平衡常数K=64;
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.1mol•L-1•min-1;64;b;
(3)实验室用Zn和稀硫酸制取H2,反应过程中氢离子浓度减小,反应时溶液中水的电离平衡正向进行,若加入少量下列试剂中生成氢气反应速率增大的是;
a.加入NaNO3 溶液相当于稀释溶液浓度减小,反应速率减小,故a不符合;
b.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故b符合;
c.加入Na2SO4溶液相当于稀释溶液浓度减小,反应速率减小,故c不符合;
d.加入NaHSO3 溶液会消耗硫酸,生成氢气的反应速率减小,故d不符合;
故答案为:向右;b;
(4)生成1mol液态水,理论上放出的能量为
=286KJ,电池的能量转化率=
×100%=
×100%=80%,故答案为:80%.
b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
| 0.1mol |
| 1L |
| 0.1mol/L |
| 2min |
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min);根据方程式计算平衡浓度,c(H2)=0.1mol/L,c(I2)=0.1mol/L,c(HI)=0.8mol/L,写出平衡常数表达式计算:K=
| c(H 2)c(I 2) |
| c 2(HI) |
| 0.1×0.1 |
| 0.8 2 |
| 1 |
| 64 |
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.1mol•L-1•min-1;64;b;
(3)实验室用Zn和稀硫酸制取H2,反应过程中氢离子浓度减小,反应时溶液中水的电离平衡正向进行,若加入少量下列试剂中生成氢气反应速率增大的是;
a.加入NaNO3 溶液相当于稀释溶液浓度减小,反应速率减小,故a不符合;
b.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故b符合;
c.加入Na2SO4溶液相当于稀释溶液浓度减小,反应速率减小,故c不符合;
d.加入NaHSO3 溶液会消耗硫酸,生成氢气的反应速率减小,故d不符合;
故答案为:向右;b;
(4)生成1mol液态水,理论上放出的能量为
| 572KJ |
| 2 |
| 实际生成量 |
| 理论生成量 |
| 228.8KJ |
| 286KJ |
看了硫-碘循环分解水制氢主要涉及下...的网友还看了以下:
复数计算:(1)i+i^2+i^3+.+i^100(2)i^10+i^20+i^30+.+i^80 2020-05-21 …
已知集合A={1234},函数fx的定义域,值域都是A,且对于任意i∈A,f(i)≠i.(求答疑) 2020-06-08 …
2.一个静止的氢离子(H+)在电场中被加速而获得的速率为一静止的氧离子(O+2)在同一电场中且通过 2020-07-12 …
有关复数的题目一.巳知1+x+x^2=0,求证:x^1979+x^1989+x^1999=0二.设 2020-08-01 …
复数z满足(z-3)(2-i)=5(i为虚数单位),则z的共轭复数.z为()A.2+iB.2-iC 2020-08-02 …
已知an=2n,把数列{an}的各项排成如右侧三角形状,记A(i,j)表示第i行中第j个数,则结论① 2020-11-01 …
关于普通年金终值计算公式,始终搞不明白怎么来的书上是这样的:F=A(1+i)^0+A(1+i)^1+ 2020-11-01 …
计算:(1)(-1+i)(2+i)i3(2)1-i(1+i)2+1+i(1-i)2. 2020-11-01 …
已知i是虚数单位,则复数(1+2i)(1−i)2−i等于()A.1+iB.1-iC.-1+iD.-1 2020-11-01 …
定义n!=k×2×…×n.如图是求k0!的程序框图,则在判断框内应填的条件是()A.i<10B.i> 2021-01-15 …