早教吧作业答案频道 -->化学-->
锡(Sn)是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn
题目详情
锡(Sn)是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度.
(1)Sn的基态原子的价层电子排布式为___.
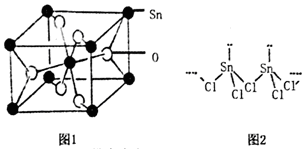
(2)锡的某种氧化物的晶胞如右图,其化学式为___.
(3)解释白锡的密度大于灰锡的密度的原因___.
(4)SnCl4分子的空间构型为___;SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为___.
(5)SnCl2的一维链状聚合结构如图2所示,在分子结构中存在的化学键是___,其固体分子及气体分子中Sn的杂化方式分别为___.
(6)若灰锡的晶胞边长为a=648.9 pm,计算灰锡的密度 为___ g/cm3(列出计算式即可),Sn的原子半径为___(已知
≈1.732,计算结果保留4位有效数字).

(1)Sn的基态原子的价层电子排布式为___.
(2)锡的某种氧化物的晶胞如右图,其化学式为___.
(3)解释白锡的密度大于灰锡的密度的原因___.
(4)SnCl4分子的空间构型为___;SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为___.
(5)SnCl2的一维链状聚合结构如图2所示,在分子结构中存在的化学键是___,其固体分子及气体分子中Sn的杂化方式分别为___.
(6)若灰锡的晶胞边长为a=648.9 pm,计算灰锡的密度 为___ g/cm3(列出计算式即可),Sn的原子半径为___(已知
| | 3 |
▼优质解答
答案和解析
(1)Sn属于ⅣA族元素,价电子排布式为ns2np2,位于第5周期,可确定其价电子排布式为:5s25p2,
故答案为:5s25p2;
(2)晶胞中O可形成两条共价键,则图2中红球代表O原子,白球代表Sn,所以O位于体心和面心,数目为4×
=4,Sn位于顶点和体心,数目为8×
+1=2,原子数目比为2:1,写出化学式为SnO2,
故答案为:SnO2;
(3)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数为4,前者配位数较大,其空间利用率较大,所以其密度大于灰锡,故答案为:配位数大,空间利用率大;
(4)SnCl4分子价电子对数为
=4,形成了四条杂化轨道,杂化轨道空间构型为正四面体,且每条杂化轨道均与Cl形成共价键,其空间构型为正四面体;SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,则生成了NH4Cl,所以反应的方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;故答案为:正四面体;SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
(5)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键,配位键表示为由形成两条共价键的Cl指向Sn,所以在分子结构中存在的化学键是共价键、配位键;SnCl2的一维链状聚合结构中,Sn形成了四条键,杂化类型为sp3,气体分子为单分子,即形成两条共价键的Cl断开其中一条,则Sn形成三条键面,杂化类型为sp2;
故答案为:共价键、配位键;sp3、sp2;
(6)灰锡晶胞中含有8个Sn原子,晶胞的摩尔质量为:119×8=952g/mol,晶胞的体积为(a×10-10)3,摩尔体积为NA(a×10-10)3,所以密度为
=
,设半径为r;原子紧密相邻,则r=
×
a═
×
×648.9pm=140.5pm,
故答案为:
;140.5pm.
故答案为:5s25p2;
(2)晶胞中O可形成两条共价键,则图2中红球代表O原子,白球代表Sn,所以O位于体心和面心,数目为4×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:SnO2;
(3)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数为4,前者配位数较大,其空间利用率较大,所以其密度大于灰锡,故答案为:配位数大,空间利用率大;
(4)SnCl4分子价电子对数为
| 4+4 |
| 2 |
(5)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键,配位键表示为由形成两条共价键的Cl指向Sn,所以在分子结构中存在的化学键是共价键、配位键;SnCl2的一维链状聚合结构中,Sn形成了四条键,杂化类型为sp3,气体分子为单分子,即形成两条共价键的Cl断开其中一条,则Sn形成三条键面,杂化类型为sp2;
故答案为:共价键、配位键;sp3、sp2;
(6)灰锡晶胞中含有8个Sn原子,晶胞的摩尔质量为:119×8=952g/mol,晶胞的体积为(a×10-10)3,摩尔体积为NA(a×10-10)3,所以密度为
| 952 |
| NA(a×10-10)3 |
| 952 |
| 6.02×1023×(648.9×10-10)3 |
| 1 |
| 2 |
| ||
| 4 |
| 1 |
| 2 |
| ||
| 4 |
故答案为:
| 952 |
| 6.02×1023×(648.9×10-10)3 |
看了 锡(Sn)是人类最早使用的元...的网友还看了以下:
定义一种对正整数n的F运算定义一种对正整数n的"F"运算1.当n为奇数时,结果为3n+5;2.当n 2020-04-06 …
数列求和公式(n-4)(n-3)(n-2)(n-1)nb^5+5X(n-3)(n-2)(n-1)n 2020-05-13 …
定义一种对正整数n的f运算定义一种对正整数n的"F"运算1.当n为奇数时,结果为3n+5;2.当n 2020-05-22 …
我国有悠久的青铜器铸造史.先秦古籍《考古记》记载了各种铸造的青铜器中锡、铜的质量比:鼎1:6,锡1 2020-06-26 …
请教catalan数网上对catalan数的通项有两种说法一种说catalan数满足递归式:h(n 2020-06-28 …
N个一样的球,放到M个有编号的箱子里,有多少种放法?举例N=3,M=2,有4种方法:3,0,;2, 2020-07-14 …
1.关于求通项公式的,不太懂累加法和累乘法的,已知数列{A满足An+1=2^n+1*An/An+2 2020-07-15 …
若某共价化合物分子中只含有C、H、O、N四种元素,且以n(C)、n(N)、n(O)分别表示C、N、 2020-07-20 …
贵求各种拆项公式的推导请帮我把下列各种公式推导下,让我知道他们的由来谢谢了(1)1/n(n+1)= 2020-07-23 …
集合中有n个元素,则集合的子集有2^n个求推导过程(不要那种以特殊数值得出的答案)最好是利用组合数 2020-07-29 …