早教吧作业答案频道 -->化学-->
甲醇和乙醇是重要的化工原料,也是清洁的能源.(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)△H1反
题目详情
甲醇和乙醇是重要的化工原料,也是清洁的能源.
(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:
反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)△H1
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)△H2>0
反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)△H3>0
①分析增大压强对制备乙醇的影响___.
②反应①乙酸甲酯的平衡转化率与温度和氢碳比(
)的关系如图1.
该反应的平衡常数K随温度升高___.(填“变大”“不变”或“变小”);氢碳比最大的是曲线___.
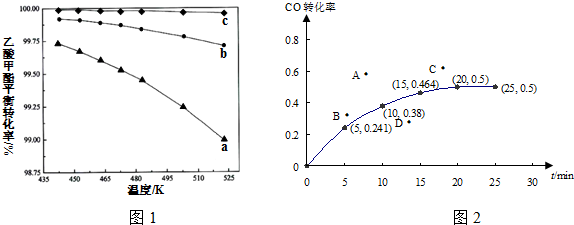
(2)①利用反应CO(g)+2H2(g)⇌CH3OH(g)合成甲醇.某温度下,向容积为2L的密闭容器中加入1mol CO和2mol H2,CO转化率的变化如图2所示,该温度下的平衡常数为___(保留两位有效数字,下同),若起始压强为12.6MPa,则10min时容器的压强为___.
②若保持其它条件不变,起始时加入2mol CO和2mol H2,再次达到平衡,相应的点是___.
(3)氢气可用CH4制备:CH4(g)+H2O(1)⇌CO(g)+3H2(g)△H=+250.1kJ•mol-1.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJ•mol-1,请写出表示甲烷燃烧热的热化学方程式___.以CH4(g)为燃料可以设计甲烷燃料电池,已知该电池的能量转换效率为86.4%,则该电池的比能量为___kW•h•kg-1(只列计算式,比能量=
,lkW•h=3.6×106J).
(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:
反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)△H1
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)△H2>0
反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)△H3>0
①分析增大压强对制备乙醇的影响___.
②反应①乙酸甲酯的平衡转化率与温度和氢碳比(
| n(H2) |
| n(乙酸甲酯) |
该反应的平衡常数K随温度升高___.(填“变大”“不变”或“变小”);氢碳比最大的是曲线___.

(2)①利用反应CO(g)+2H2(g)⇌CH3OH(g)合成甲醇.某温度下,向容积为2L的密闭容器中加入1mol CO和2mol H2,CO转化率的变化如图2所示,该温度下的平衡常数为___(保留两位有效数字,下同),若起始压强为12.6MPa,则10min时容器的压强为___.
②若保持其它条件不变,起始时加入2mol CO和2mol H2,再次达到平衡,相应的点是___.
(3)氢气可用CH4制备:CH4(g)+H2O(1)⇌CO(g)+3H2(g)△H=+250.1kJ•mol-1.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJ•mol-1,请写出表示甲烷燃烧热的热化学方程式___.以CH4(g)为燃料可以设计甲烷燃料电池,已知该电池的能量转换效率为86.4%,则该电池的比能量为___kW•h•kg-1(只列计算式,比能量=
| 电池输出电能(kW•h) |
| 燃料质量(kg) |
▼优质解答
答案和解析
(1)压强越大反应速率越快,而反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)正向气体计量数减小,所以平衡正向移动,
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,增大压强平衡不移动,反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)正向气体计量数增加,增大压强平衡逆向移动,故答案为:增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应,所以温度升高K值减小;乙酸甲酯的转化率越小,则氢碳比(
)越大,所以最大的是c,故答案为:变小; c;
(2)①CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=
=
=4.0,
=
,所以P=9.4 MPa,故答案为:4.0;9.4 MPa;
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小,所以点B符合,故答案为:B;
(3)①CH4(g)+H2O(1)⇌CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ•mol-1
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
设燃料为1kg,放出的能量为
×890.3KJ×86.4%=4.8×107J;比能量为
,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
.
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,增大压强平衡不移动,反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)正向气体计量数增加,增大压强平衡逆向移动,故答案为:增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应,所以温度升高K值减小;乙酸甲酯的转化率越小,则氢碳比(
| n(H2) |
| n(乙酸甲酯) |
(2)①CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.25 |
| 0.25×0.52 |
| 12.6 |
| 3 |
| P |
| 3-0.38×2 |
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小,所以点B符合,故答案为:B;
(3)①CH4(g)+H2O(1)⇌CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
设燃料为1kg,放出的能量为
| 1000 |
| 16 |
| 4.8×107J |
| 3.6×106J |
| 4.8×107J |
| 3.6×106J |
看了 甲醇和乙醇是重要的化工原料,...的网友还看了以下:
研究发现,NOx和SO2是雾霾的主要成分.Ⅰ.NOx主要来源于汽车尾气.已知:N2(g)+O2(g 2020-05-14 …
一次函数g(x)满足g[g(x)]=9x+8,则g(x)是()A.g(x)=9x+8B.g(x)= 2020-05-14 …
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2( 2020-05-16 …
体积相同但材料不同的甲、乙、丙三个小球,放在同一液体中静止后的位置,如图所示,三个小球所受重力间的 2020-06-16 …
举世瞩目的三峡大坝设计高度为185m.大型轮船通过大坝要通过船闸.船闸的工作原理是;如果蓄水高度为 2020-06-24 …
修青藏铁路要测A.B两地的高度差,因地形情况,不易测出,我们在AB两点间找到合适的四个点,D.E. 2020-07-06 …
修青藏铁路要测A.B两地的高度差,因地形情况,不易测出,我们在AB两点间找到合适的四个点,D.E. 2020-07-06 …
(2006•咸宁)如图,A,B,C,D,E,G,H,M,N都是方格纸中的格点(即小正方形的顶点),要 2020-11-12 …
盐城市某初级中学积极倡导同学们利用课余时间进行实践探究活动。在探究活动的过程中,我们应该注意的是A. 2020-11-29 …
(2006•大连)如图所示,工人用动滑轮把重物匀速提升到一定高度,重物的重力为G物,动滑轮的重力为G 2020-11-30 …