早教吧作业答案频道 -->化学-->
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、M
题目详情
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下: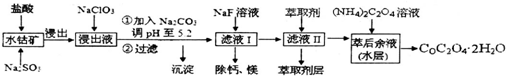
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是___.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为___
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:___
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液
=___.
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为___左右.
(6)已知:
NH3•H2O⇌NH4++OH- Kb=1.8×10-5
H2C2O4⇌H++H2CO4- K a1=5.4×10-2
H2CO4-⇌H+C2O42- K a2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”)
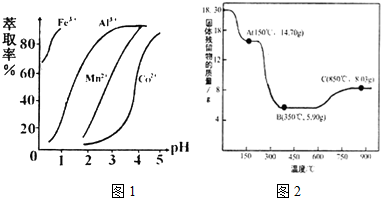
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是___.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为___
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:___
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液
| c(Mg2+) |
| c(Ca2+) |
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为___左右.

(6)已知:
NH3•H2O⇌NH4++OH- Kb=1.8×10-5
H2C2O4⇌H++H2CO4- K a1=5.4×10-2
H2CO4-⇌H+C2O42- K a2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是___.
▼优质解答
答案和解析
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,还原为Fe2+、Co2+,
故答案为:还原Fe3+、Co3+为Fe2+、Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O⇌R(OH)3+3H+,:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,
故答案为:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O⇌R(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)当加入过量NaF后,所得滤液
=
=
=
=0.7,
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:3.0~3.5;
(6)盐类水解,谁强显谁性,NH3•H2O⇌NH4++OH- Kb=1.8×10-5,HCO4-⇌H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(7)由图可知,C点钴氧化物质量为8.03g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:
≈3:4,故C的Co氧化物为Co3O4,
故答案为:Co3O4(或CoO•Co2O3).
故答案为:还原Fe3+、Co3+为Fe2+、Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O⇌R(OH)3+3H+,:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,
故答案为:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O⇌R(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)当加入过量NaF后,所得滤液
| C(Mg2+) |
| C(Ca2+) |
| ||
|
| Ksp(MgF2) |
| Ksp(CaF2) |
| 7.35×10-11 |
| 1.05×10-10 |
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:3.0~3.5;
(6)盐类水解,谁强显谁性,NH3•H2O⇌NH4++OH- Kb=1.8×10-5,HCO4-⇌H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(7)由图可知,C点钴氧化物质量为8.03g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:
| 2.13g |
| 16g/mol |
故答案为:Co3O4(或CoO•Co2O3).
看了 草酸钴可用于指示剂和催化剂的...的网友还看了以下:
已知f(x)=sin(ωx+φ)(ω>0,|φ|≤π/2)为奇函数,且图像上相邻的一个最高点和最低 2020-06-05 …
某氧化剂中,起氧化作用的是X2O7(2-)离子,在溶液中0.2mol该离子恰好能使0.6mol的S 2020-06-26 …
平面内一动点P到点F(2,0)的距离比它到直线x+3=0的距离少1平面内一动点P到点F(2,0)的 2020-06-27 …
若半径为r的圆C,x^2+y^2+Dx+Ey+F=0,的圆心C到直线l:Dx+Ey+F=0的距离为 2020-07-26 …
一道三角函数题已知函数f(x)=Acos^2(ωx+φ)(A>0,ω>0)的最大值为3,f(x)的 2020-07-30 …
椭圆x^2/a^2+y^2/b^2=1(a>b>0)的右焦点为F,离心率是1/2,过F作直线l交椭 2020-08-01 …
从某物质A的水溶液出发有如图所示的一系列变化:试回答:(1)物质的化学式:A、C、D、E、F.(2) 2020-11-22 …
从某物质A的水溶液出发有如图所示的一系列变化:试回答:(1)物质的化学式:A、C、D、E、F.(2) 2020-11-22 …
已知函数f(x)=Asin^2(wx+y){A大于0,w大于0,y大于0小于3.1415./2),且 2020-12-08 …
从下列微粒中选择适当的微粒序号填空A、分子B、原子C、阳离子D、阴离子E、质子F、中子G、电子(1) 2020-12-12 …