早教吧作业答案频道 -->化学-->
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如1图实验:现称取研细的黄铜矿样品1.84g,在空气存在下进行煅
题目详情
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如1图实验:
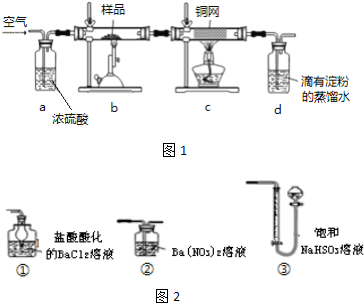
现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
置于锥形瓶中,用0.05mol/L 标准碘溶液进行滴定,消耗标准溶液 20mL.
请回答下列问题:
(1)将样品研细后再反应,其目的是___.
(2)装置a和c的作用分别是___和___(填标号,可以多选).
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)滴定达终点时的现象是___.
(4)上述反应结束后,仍需通一段时间的空气,其目的是___.
(5)通过计算可知,该黄铜矿的纯度为___.
乙同学在甲同学实验的基础上,设计了两种与甲不同的吸收方法,并对吸收产物进行有关处理,同样也测出了黄铜矿的纯度.
(6)方法一:用如图2装置替代上述实验装置 d,同样可以达到实验目的是___(填序号).
(7)方法二:将原装置 d 中的试液改为Ba(OH)2,但测得的黄铜矿纯度却产生了+1%的误差,假设实验操作均正确,可能的原因主要有___.

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
| 1 |
| 10 |
请回答下列问题:
(1)将样品研细后再反应,其目的是___.
(2)装置a和c的作用分别是___和___(填标号,可以多选).
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)滴定达终点时的现象是___.
(4)上述反应结束后,仍需通一段时间的空气,其目的是___.
(5)通过计算可知,该黄铜矿的纯度为___.
乙同学在甲同学实验的基础上,设计了两种与甲不同的吸收方法,并对吸收产物进行有关处理,同样也测出了黄铜矿的纯度.
(6)方法一:用如图2装置替代上述实验装置 d,同样可以达到实验目的是___(填序号).
(7)方法二:将原装置 d 中的试液改为Ba(OH)2,但测得的黄铜矿纯度却产生了+1%的误差,假设实验操作均正确,可能的原因主要有___.
▼优质解答
答案和解析
该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,
故答案为:增大接触面积,使原料充分反应、加快反应速率;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量;灼热的铜网可以除去多余的氧气,
故答案为:bd;e;
(3)当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点,
故答案为:锥形瓶中的溶液由无色变为蓝色且半分钟不褪色,
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:
×100%=50%,
故答案为:50%;
(6)由于图2中,②硝酸钡溶液中通入二氧化硫能够生成硫酸钡沉淀,过滤干燥后,根据硫酸钡的质量计算出二氧化硫的质量,
故答案为:②;
(7)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,
故答案为:增大接触面积,使原料充分反应、加快反应速率;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量;灼热的铜网可以除去多余的氧气,
故答案为:bd;e;
(3)当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点,
故答案为:锥形瓶中的溶液由无色变为蓝色且半分钟不褪色,
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:
| 0.92g |
| 1.84g |
故答案为:50%;
(6)由于图2中,②硝酸钡溶液中通入二氧化硫能够生成硫酸钡沉淀,过滤干燥后,根据硫酸钡的质量计算出二氧化硫的质量,
故答案为:②;
(7)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
看了 黄铜矿是工业炼铜的主要原料,...的网友还看了以下:
一质量为m=4kg的玩具车,以恒定功率p0在平直路面上加速行驶,t=10s内走过s=14m,且小车 2020-04-13 …
已知集合s是满足下列条件的函数f(4)的全体:在定义域内存在实数40,使口f(40+1)=f(40 2020-05-13 …
1.对每个正整数n,用S(n)表示n的各位数字之和,那么有()个n使得n+S(n)+S(S(n)) 2020-05-21 …
如果力F在时间t内能使质量为m原来静止的物体产生位移为s,那么相同的力在相同的时间内使质量是一半的 2020-06-05 …
已知函数y=f(x)在t=0处可导,且具有性质f(t+s)=(f(t)+f(s))/(1-f(t) 2020-06-08 …
复变函数求拉氏逆变换1.F(s)=s的平方+1分之一2.F(s)=s的平复变函数求拉氏逆变换1.F 2020-06-23 …
信号与系统:已知信号f(t)的拉氏变换F(s)=1-----------,则f(t)的初值和终值为 2020-07-13 …
若函数f(x)在[0,1]上满足:对于任意的s,t∈[0,1],λ>0,都有f(s)+λf(t)1+ 2020-11-19 …
感激不尽.对定义域在S=[1,正无穷)的函数f(x),对任意x属于[1,正无穷)满足对定义域在S=[ 2020-12-09 …
已知F(s)=ln(s+1/s-1),求F(s)的拉普拉斯逆变换. 2021-01-07 …