常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是()A.H2A⇌2H++A2-K=10-5.4B.在0.1mol/LNaHA溶液中,各离子
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )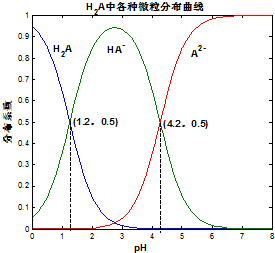
A. H2A⇌2H++A2- K=10-5.4
B. 在 0.1mol/L NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F-═HF+HA-
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
| c(H+)×c(HA-) |
| c(H2A) |
pH=4.2时,HA-、A2-浓度相等,且二者浓度相等,电离方程式为HA-⇌H++A2-,则K2=
| c(H+)×c(A2-) |
| c(HA-) |
A.H2A部分电离,分步电离,以第一步电离为主,则电离方程式为H2A⇌H++HA-,故A错误;
B.pH=4.2时,HA-、A2-浓度相等,溶液呈酸性,说明HA-电离程度大于HA-水解程度,则在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+),因还存在水的电离,则c(H+)>c(A2-)>c(OH-),所以各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;
C.已知25℃时HF的Ka=10-3.45,由以上信息可知K1=
| c(H+)×c(HA-) |
| c(H2A) |
| c(H+)×c(A2-) |
| c(HA-) |
D.将等物质的量的NaHA、Na2A溶于水中,HA-、A2-浓度相等,K2=
| c(H+)×c(A2-) |
| c(HA-) |
故选A.
关于化学反应的△H的理解正确的是()A.△H>0的反应是吸热反应B.△H=ΣH(反应物)-ΣH(生 2020-04-11 …
已知:H2A=H++HA-、HA-⇌H++A2-,相同条件下,等物质的量浓度的下列稀溶液:①NaH 2020-04-12 …
A2-原子核内x有个中子.其质量数为m.则n克A2-所含的物质的量为?用的公式也要写出来所含电子物 2020-05-13 …
某二元酸(H2A)在水中的电离式为:H2A=H++HA-,HA-⇌H++A2-,则下列说法正确的是 2020-05-14 …
C的化合物多还是H的化合物多?C形成的化合物多还是H形成的化合物多?为什么?有机物里的所有H都可以 2020-05-23 …
一个物体从H高处自由落下,经过最后196m所用的时间是4s,求物体下落H高所用的总时间T和高度H是 2020-07-18 …
有甲、乙两球,甲球由塔顶自由下落,当它下落高度a时,乙球在塔顶下与塔顶距离为b处开始自由下落,结果 2020-07-29 …
(2009•江门一模)某二元酸(H2A)在水中的电离方程式:H2A=H++HA-,HA-⇌H++A2 2020-11-12 …
某物质A2.0g与足量的氧气完全反应,可生成4.4g的二氧化碳和3.6g水,则下列关于物质A描述正确 2021-01-01 …
化学电离平衡的问题,求解某二元酸(H2A)在水中的电离方程式为H2A===H++HA-,HA-⇌H+ 2021-01-04 …