I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴ 提出假设:
假设 1 :该固体物质是 FeCl 2
假设 2 :该固体物质是 FeCl 3
假设 3 :该固体物质是
⑵ 设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN 溶液 |
| 固体物质中有 FeCl 3 |
| 在 KMnO 4 溶液中加少量 A 溶液 | KmnO 4 溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤:
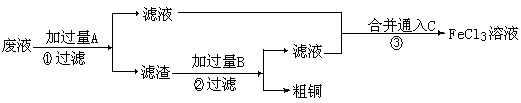
⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:
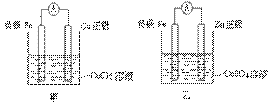
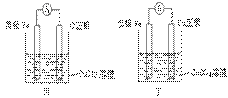
四位同学的设计的原电池装置图,符合上述反应原理的是 。
③ 请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴ 提出假设:
假设 1 :该固体物质是 FeCl 2
假设 2 :该固体物质是 FeCl 3
假设 3 :该固体物质是
⑵ 设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN 溶液 |
| 固体物质中有 FeCl 3 |
| 在 KMnO 4 溶液中加少量 A 溶液 | KmnO 4 溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤:

⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③ 请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 3 3 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 3 2 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 2 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 3 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 2 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 2⑴ 提出假设:
⑴ 提出假设: 提出假设:假设 1 :该固体物质是 FeCl 2
假设 1 :该固体物质是 FeCl 2 1 :该固体物质是 FeCl 2 FeCl 2 2假设 2 :该固体物质是 FeCl 3
假设 2 :该固体物质是 FeCl 3 2 :该固体物质是 FeCl 3 FeCl 3 3假设 3 :该固体物质是
假设 3 :该固体物质是 3 :该固体物质是⑵ 设计实验方案:
⑵ 设计实验方案: 设计实验方案:取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表: A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表: A 溶液分别进行实验,实验现象与结论如下表:| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN 溶液 |
| 固体物质中有 FeCl 3 |
| 在 KMnO 4 溶液中加少量 A 溶液 | KmnO 4 溶液颜色无明显变化 | 固体物质中不含 |
实验方法
实验现象
结论
在溶液中加 KSCN 溶液
固体物质中有 FeCl 3
在 KMnO 4 溶液中加少量 A 溶液
KmnO 4 溶液颜色无明显变化
固体物质中不含
实验方法
实验现象
结论
实验方法
实验方法
实验方法实验现象
实验现象
实验现象结论
结论
结论在溶液中加 KSCN 溶液
固体物质中有 FeCl 3
在溶液中加 KSCN 溶液
在溶液中加 KSCN 溶液
在溶液中加 KSCN 溶液 KSCN 溶液
固体物质中有 FeCl 3
固体物质中有 FeCl 3
固体物质中有 FeCl 3 FeCl 3 3在 KMnO 4 溶液中加少量 A 溶液
KmnO 4 溶液颜色无明显变化
固体物质中不含
在 KMnO 4 溶液中加少量 A 溶液
在 KMnO 4 溶液中加少量 A 溶液
在 KMnO 4 溶液中加少量 A 溶液 KMnO 4 溶液中加少量 A 溶液 4 A 溶液KmnO 4 溶液颜色无明显变化
KmnO 4 溶液颜色无明显变化
KmnO 4 溶液颜色无明显变化 4 溶液颜色无明显变化固体物质中不含
固体物质中不含
固体物质中不含Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤:
Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: 3 FeCl 3 溶液,设计了下列实验步骤: 3 


⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。
⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。 Cu 强的离子方程式: ,该反应在上图步骤 中发生。②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示: 





四位同学的设计的原电池装置图,符合上述反应原理的是 。
四位同学的设计的原电池装置图,符合上述反应原理的是 。③ 请写出正、负极的电解反应式:
③ 请写出正、负极的电解反应式: 请写出正、负极的电解反应式:正极: 、负极: (电极反应式)。
正极: 、负极: (电极反应式)。⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式⑴ FeCl 2 和 FeCl 3 ; ⑵ 溶液呈红色; FeCl 2 ; ⑶①Fe + Cu 2 + = Fe 2+ + Cu ; ① ; ② 甲、丙、丁; ③Cu 2 + +2e - =Cu ; Fe - 2e - =Fe 2 + ; ⑷ 粗铜; Cu-2e - =Cu 2+ 。
解析 : I . 根据铁与硝酸在不同条件下可被氧化成两种产物,推断铁粉与 Cl 2 反应也可能生成 FeCl 2 或 FeCl 3 或两种物质的混合物。根据 KSCN 溶液能与 Fe 3 + 显红色,可检验产物中是否含有 FeCl 3 。根据酸性 KMnO 4 溶液能氧化 Fe 2 + 而退色,可验证产物中是否含有 FeCl 2 。
Ⅱ. 从腐蚀废液中回收铜的实验过程如下:

利用 Fe 能从 CuCl 2 溶液中置换出铜,来证明 Fe 比 Cu 的还原性强。反应方程式为: Fe + CuCl 2 = Cu + FeCl 2 。用该反应设计原电池时可用 Fe 作负极, Cu (或者碳)作正极, CuCl 2 溶液后 CuSO 4 溶液作电解质的溶液。电解精炼铜时,粗铜作阳极 (Cu-2e - =Cu 2+ ) ,纯铜作阴极 (Cu 2 + + 2e - →Cu) ,含 Cu 2 + 的溶液作电解质的溶液。
⑴ FeCl 2 和 FeCl 3 ; ⑵ 溶液呈红色; FeCl 2 ; ⑶①Fe + Cu 2 + = Fe 2+ + Cu ; ① ; ② 甲、丙、丁; ③Cu 2 + +2e - =Cu ; Fe - 2e - =Fe 2 + ; ⑷ 粗铜; Cu-2e - =Cu 2+ 。
⑴ FeCl 2 2 和 FeCl 3 3 ; ⑵ 溶液呈红色; FeCl 2 2 ; ⑶①Fe + Cu 2 2 + + = Fe 2+ 2+ + Cu ; ① ; ② 甲、丙、丁; ③Cu 2 2 + + +2e - - =Cu ; Fe - 2e - - =Fe 2 2 + + ; ⑷ 粗铜; Cu-2e - - =Cu 2+ 2+ 。解析 : I . 根据铁与硝酸在不同条件下可被氧化成两种产物,推断铁粉与 Cl 2 反应也可能生成 FeCl 2 或 FeCl 3 或两种物质的混合物。根据 KSCN 溶液能与 Fe 3 + 显红色,可检验产物中是否含有 FeCl 3 。根据酸性 KMnO 4 溶液能氧化 Fe 2 + 而退色,可验证产物中是否含有 FeCl 2 。
解析 : 解析 : I . 根据铁与硝酸在不同条件下可被氧化成两种产物,推断铁粉与 Cl 2 2 反应也可能生成 FeCl 2 2 或 FeCl 3 3 或两种物质的混合物。根据 KSCN 溶液能与 Fe 3 3 + + 显红色,可检验产物中是否含有 FeCl 3 3 。根据酸性 KMnO 4 4 溶液能氧化 Fe 2 2 + + 而退色,可验证产物中是否含有 FeCl 2 2 。Ⅱ. 从腐蚀废液中回收铜的实验过程如下:
Ⅱ. 从腐蚀废液中回收铜的实验过程如下: 

利用 Fe 能从 CuCl 2 溶液中置换出铜,来证明 Fe 比 Cu 的还原性强。反应方程式为: Fe + CuCl 2 = Cu + FeCl 2 。用该反应设计原电池时可用 Fe 作负极, Cu (或者碳)作正极, CuCl 2 溶液后 CuSO 4 溶液作电解质的溶液。电解精炼铜时,粗铜作阳极 (Cu-2e - =Cu 2+ ) ,纯铜作阴极 (Cu 2 + + 2e - →Cu) ,含 Cu 2 + 的溶液作电解质的溶液。
利用 Fe 能从 CuCl 2 2 溶液中置换出铜,来证明 Fe 比 Cu 的还原性强。反应方程式为: Fe + CuCl 2 2 = Cu + FeCl 2 2 。用该反应设计原电池时可用 Fe 作负极, Cu (或者碳)作正极, CuCl 2 2 溶液后 CuSO 4 4 溶液作电解质的溶液。电解精炼铜时,粗铜作阳极 (Cu-2e - - =Cu 2+ 2+ ) ,纯铜作阴极 (Cu 2 2 + + + 2e - - →Cu) ,含 Cu 2 2 + + 的溶液作电解质的溶液。人的智慧掌握着三把钥匙,一把开启数字,一把开启字母,一把开启音符.知识、思想、幻想就在其中.请解释 2020-06-08 …
人的智慧掌握这把钥匙,一把开启数字,一把开启字母,一把开启音符.知识、思想、幻想就在其中.道理是什 2020-06-08 …
为什么开启人类智慧的宝库有三把钥匙、一把是数学、一把是字母、一把是音符 2020-06-08 …
成熟的麦穗低着头,那是启示我们要谦虚;一群蚂蚁抬着骨头,那是启示我们;冰雪中傲然挺立的雪松,那是启 2020-06-18 …
阅读步步高。美的启发我家住在古城一角,窗外有一块空地,附近的居民竟把它当成了堆垃阅读步步高。美的启 2020-06-22 …
仿写句子.大自然能给我们许多启示:成熟的稻穗低着头,那是在启示我们要谦虚:一群蚂蚁抬走骨头,那是在 2020-06-23 …
“这是很紧要的一个时期,上承着培根、洛克的实验哲学,下启了启蒙时期的思想家们。所以17世纪是启蒙的 2020-07-12 …
读句子,照样子把句补充整.大自然能给我们许多启示:成熟的稻子低着子,那是启示我们要谦虚;一群蚂蚁抬起 2020-11-08 …
日光灯一闪一闪点不亮就镇流器+灯管+启辉器的那种。。。。。本来以为启辉器坏了。。把好的日光灯上的换上 2020-11-25 …
为什么定子绕组接成星型的直接启动电压是三角形直接启动电压1/√3.启动电流是他的1/3呢!然而把他接 2020-12-25 …