早教吧作业答案频道 -->化学-->
葡萄酒常用Na2S2O5做抗氧化剂.(1)1.90gNa2S2O5最多能还原mLO2(标准状况).(2)0.5molNa2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O
题目详情
葡萄酒常用Na2S2O5做抗氧化剂.
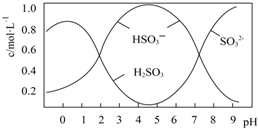
(1)1.90g Na2S2O5最多能还原___mLO2(标准状况).
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶解于水的化学方程式___;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是___;
已知:Ksp[BaSO4]=110-10,Ksp[BaSO3]=510-7.把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤110-5mol•L-1],此时溶液中c(SO32-)≤___mol•L-
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O═H2SO4+2HI):
准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol•L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗氧化剂的残留量 (单位:mg•L-1,以SO2计算,请给出计算过程.)

(1)1.90g Na2S2O5最多能还原___mLO2(标准状况).
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶解于水的化学方程式___;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是___;
已知:Ksp[BaSO4]=110-10,Ksp[BaSO3]=510-7.把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤110-5mol•L-1],此时溶液中c(SO32-)≤___mol•L-
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O═H2SO4+2HI):
准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol•L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗氧化剂的残留量 (单位:mg•L-1,以SO2计算,请给出计算过程.)
▼优质解答
答案和解析
(1)在Na2S2O5与O2的反应中,硫从+4价升为+6价,氧从0价降为-2价,1.90g Na2S2O5的物质的量为0.01mol,根据电子得失守恒可知能还原氧气的物质的量为0.01mol,即标准状况224mL,
故答案为:224;
(2)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
=
=10-5mol•L-1,则溶液中SO32-的最大浓度c(SO32-)=
=
=0.05mol•L-1,
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;0.05;
(3)根据题意可知,消耗标准I2溶液的体积为
=16.0mL,所以I2的物质的量为16.0×10-3L×0.0225mol•L-1=3.6×10-4mol,根据反应SO2+I2+2H2O=H2SO4+2HI,可知二氧化硫的物质的量为3.6×10-4mol,SO2的质量为64g/mol×3.6×10-4mol=23.04mg,所以葡萄酒样品中抗氧化剂的残留量为
=230.4mg•L-1,答:残留量为230.4mg•L-1.
故答案为:224;
(2)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
| Ksp(BaSO4) | ||
c(S
|
| 1×10-10 |
| 1×10-5 |
| Ksp(BaSO3) |
| c(Ba2+) |
| 5×10-7 |
| 10-5 |
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;0.05;
(3)根据题意可知,消耗标准I2溶液的体积为
| 15.98mL+16.02mL |
| 2 |
| 23.04mg |
| 0.1L |
看了 葡萄酒常用Na2S2O5做抗...的网友还看了以下:
求并证明数列1^2+2^2+3^2+4^2+.+2^n请高手用n化简表示并证明!证明!证明啥叫归纳法 2020-03-30 …
Y=sinnx在[0,π/n]的面积为2/nx=ax=b及x轴所围成图形的面积称为函数f(x)在[ 2020-05-20 …
编写计算斐波那契数列前20个值得程序,数列定义如下:F(0)=0,F(1)=1,F(N)=F(N- 2020-07-23 …
微分方程求解:y''=y^(-1/2),怎么解?过程!急!答案是x+m=2/3(y^(1/2)+n 2020-07-31 …
大学微积分问题,紧急求极限的问题一:用数列的定义证明1:lim{(3n+2)/(n+3)}=3/2 2020-07-31 …
微积分,已知∑(0,∞)Cn*4^n收敛,请问为什么∑(0,∞)Cn*(-4)^n发散,还有证明∑ 2020-07-31 …
一个极限证明题!达人帮下忙!lim(X趋于无穷)n/[(n^2+n)^(1/2)]lim(X趋于无 2020-08-01 …
计算完全平方公式或者稍微详细讲一下方法(a+1/3)^2(a-1/3)^2(m-n)(m^2-n^ 2020-08-03 …
下列有关物质鉴别方案正确的是()A.用Ba(OH)2溶液可以鉴别(NH4)2CO3、(NH4)2SO 2020-11-03 …
下列离子方程式书写不正确的是()A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3 2021-02-01 …