早教吧作业答案频道 -->化学-->
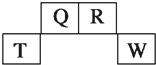
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T元素的离子结构示意图为.(2)元素的非金属性(原子得电子的能
题目详情
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T元素的离子结构示意图为___.
(2)元素的非金属性(原子得电子的能力):Q___W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为___
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是___其反应物的电子式为___.离子半径T3+___R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是___.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T元素的离子结构示意图为___.
(2)元素的非金属性(原子得电子的能力):Q___W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为___
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是___其反应物的电子式为___.离子半径T3+___R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是___.

3+3-

(1)T元素的离子结构示意图为___.
(2)元素的非金属性(原子得电子的能力):Q___W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为___
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是___其反应物的电子式为___.离子半径T3+___R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是___.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T元素的离子结构示意图为___.
(2)元素的非金属性(原子得电子的能力):Q___W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为___
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是___其反应物的电子式为___.离子半径T3+___R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是___.

3+3-
▼优质解答
答案和解析
短周期元素Q、R、T、W,由图可知,Q、R在第二周期,T、W在第三周期,T所处的周期序数与主族序数相等,则T在第三周期第ⅢA族,即T为Al,则Q为C,R为N,W为S.
(1)铝离子核外电子数为10,有2个电子层,最外层电子为8,则铝离子结构示意图为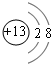 ,
,
故答案为: ;
;
(2)Q为C,W为S,硫酸的酸性大于碳酸的酸性,则非金属性S大于C,
故答案为:弱于;
(3)S和浓硫酸共热发生氧化还原反应生成二氧化硫和水,反应方程式为S+2H22SO44(浓)
3SO2+2H2O,
故答案为:S+2H2SO4(浓)
3SO2+2H2O;
(4)原子序数比N多1的元素为O,双氧水分解生成水和氧气,反应方程式为2H2O2
O2↑+2H2O,H2O2的电子式为 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
故答案为:2H2O2
O2↑+2H2O; ;<;
;<;
(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
△ △ △ △ 3SO22+2H22O,
故答案为:S+2H22SO44(浓)
3SO2+2H2O;
(4)原子序数比N多1的元素为O,双氧水分解生成水和氧气,反应方程式为2H2O2
O2↑+2H2O,H2O2的电子式为 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
故答案为:2H2O2
O2↑+2H2O; ;<;
;<;
(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
△ △ △ △ 3SO22+2H22O;
(4)原子序数比N多1的元素为O,双氧水分解生成水和氧气,反应方程式为2H22O22
O2↑+2H2O,H2O2的电子式为 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
故答案为:2H2O2
O2↑+2H2O; ;<;
;<;
(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
MnO2 MnO2 MnO2 MnO2 2 O22↑+2H22O,H22O22的电子式为 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+3+
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+3+3-3-,
故答案为:2H22O22
O2↑+2H2O; ;<;
;<;
(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
MnO2 MnO2 MnO2 MnO2 2 O22↑+2H22O; ;<;
;<;
(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO22,
故答案为:NaNO22.
(1)铝离子核外电子数为10,有2个电子层,最外层电子为8,则铝离子结构示意图为
 ,
,故答案为:
 ;
;(2)Q为C,W为S,硫酸的酸性大于碳酸的酸性,则非金属性S大于C,
故答案为:弱于;
(3)S和浓硫酸共热发生氧化还原反应生成二氧化硫和水,反应方程式为S+2H22SO44(浓)
| ||
故答案为:S+2H2SO4(浓)
| ||
(4)原子序数比N多1的元素为O,双氧水分解生成水和氧气,反应方程式为2H2O2
| ||
 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,故答案为:2H2O2
| ||
 ;<;
;<;(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:S+2H22SO44(浓)
| ||
(4)原子序数比N多1的元素为O,双氧水分解生成水和氧气,反应方程式为2H2O2
| ||
 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,故答案为:2H2O2
| ||
 ;<;
;<;(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(4)原子序数比N多1的元素为O,双氧水分解生成水和氧气,反应方程式为2H22O22
| ||
 ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+<N3-,故答案为:2H2O2
| ||
 ;<;
;<;(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
. ,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+3+
,电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径Al3+3+故答案为:2H22O22
| ||
 ;<;
;<;(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
. ;<;
;<;(5)N元素的多种氧化物,其中甲的相对分子质量最小,故甲为NO,在一定条件下,2L的NO气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,令生成的N元素的含氧酸盐中N元素化合价为x,根据电子转移守恒可知,2×(x-2)=0.5×2×2,解得x=3,故氧酸盐的化学式是NaNO22,
故答案为:NaNO22.
看了 短周期元素Q、R、T、W在元...的网友还看了以下:
已知函数fx=x-a(x+1)ln(x+1)1.当a>0时求fx极值点2.当a=1时若已知函数fx 2020-05-14 …
阅读下表(在1标准大气压下一些物质的熔点和沸点),回答问题:物质水银水铁钨锡氧熔点t/℃-3915 2020-05-14 …
物质种类铅水水银酒精甲苯凝固点/℃328-39-117-95沸点/℃174010035778111 2020-05-14 …
物质种类铅水水银酒精甲苯凝固点/℃3280-39-117-95沸点/℃17401003577811 2020-05-14 …
下表是在1标准大气压下几种液体的凝固点和沸点,如果你是一家制作温度计的厂家的技术员,要求用水银、酒 2020-05-14 …
阅读下表(在1标准大气压下一些物质的熔点和沸点),回答问题:(1)-200℃时,氧处于态。(2)水 2020-05-14 …
片段练习光明中学新开办了一个图书馆,由于没有建立规章制度,图书馆的借阅和管理制度十分混乱,主要表现 2020-05-23 …
已知函数f(x)=4x+ax+b(a,b∈R)为奇函数.(Ⅰ)若f(1)=5,求函数f(x)的解析 2020-06-09 …
1.已知f(x)为sint/t在1~x^2上的定积分,求xf(x)在0~1上的定积分.2.已知f( 2020-06-30 …
阅读下表(在1标准大气压下一些物质的熔点和沸点),回答问题:物质水银水铁钨锡氧熔点t/℃-3901 2020-07-07 …